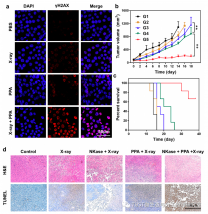
前言
过继性免疫治疗是血液学的一种变革性治疗方法,它通过基因工程在T细胞表达合成嵌合抗原受体(CAR)。针对B细胞白血病和淋巴瘤中的CD19抗原的CAR-T细胞已得到临床认可,目前成为全球范围癌症中心实施的“常规”治疗手段。在血液学和肿瘤学的其他适应症中,识别和验证新的CAR靶抗原,提高疗效和降低与CAR-T细胞治疗相关的毒性,以及促进CAR-T细胞的生产以增加患者的适用性,在转化研究方面正在做着巨大的努力。这里介绍了一系列新的靶点和技术,这些新靶点和新技术说明了研究者正在努力使CAR-T细胞疗法成为癌症医学中普遍适用和有效的治疗方法。
CAR-T细胞的新靶点
血液恶性肿瘤:在血液学中,新靶点最丰富的管线是多发性骨髓瘤。信号转导淋巴细胞活化分子(SLAM)家族的一些成员正被作为潜在的靶点,包括SLAMF7(别名:CD319,CRACC,CS-1)和SLAMF3(别名:CD229,Ly9)。SLAMF7和SLAMF3在未治疗和耐化疗的多发性骨髓瘤患者的肿瘤细胞上均匀表达,靶向任一抗原的CAR-T细胞在体外和体内实验中都表现出高效的杀伤作用。因此,SLAMF7 CAR-T细胞目前正在进入临床试验。SLAMF7在一些正常淋巴细胞亚群的一小部分细胞上表达,其结果是在CAR-T细胞制造过程中SLAMF7高表达T细胞发生自噬,因此,可能会在SLAMF7 CAR-T细胞过继转移后发生SLAMF7高表达淋巴细胞的选择性缺失。令人鼓舞的是,抗SLAMF7抗体的临床经验表明,患者保留淋巴细胞总数而不增加感染率。相比之下,SLAMF3在T细胞、B细胞和NK细胞上的表达是一致的,这表明SLAMF3可能会导致淋巴细胞耗竭,但目前尚无针对SLAMF3的临床经验。下表提供了多发性骨髓瘤、B细胞和T细胞恶性肿瘤以及急性髓性白血病(AML)中CAR-T细胞的一些其他新靶向抗原。
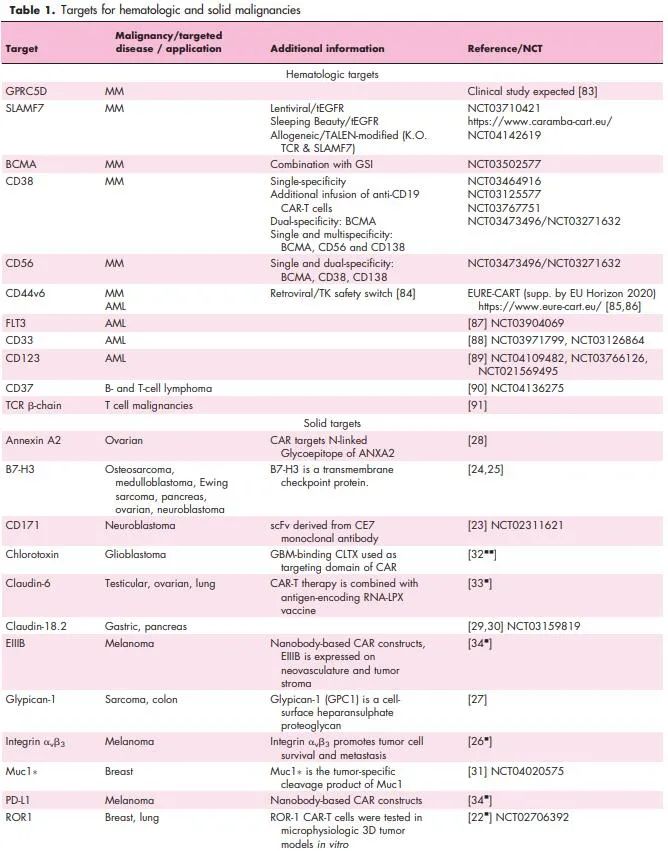
G蛋白偶联受体C型第5组成员D(GPRC5D)被发现是多发性骨髓瘤患者骨髓中mRNA筛选活动中高表达的基因,也是与不良临床预后相关的一个因素。最近的一项研究显示GPRC5D蛋白在原发性多发性骨髓瘤细胞中的表达,且GPRC5D特异性CAR-T细胞具有抗多发性骨髓瘤作用。此外,该研究确定毛囊是唯一可检测到GPRC5D表达的正常组织。值得注意的是,联合靶向BCMA和GPRC5D被证明可以防止BCMA逃逸的复发,说明了这一概念在提高临床疗效和预后方面的潜在的临床应用价值。
以往的研究报告了CD19 CAR-T细胞在多发性骨髓瘤患者中的临床疗效,尽管在临床病理学中,通过流式细胞术的常规分析,CD19在多发性骨髓瘤细胞上的检测很少。超分辨显微镜分析表明,在一部分患者的原发性多发性骨髓瘤细胞中,CD19经常表达,其分子密度足以触发CD19 CAR-T细胞的识别。这些数据表明,先进的成像技术可以用来指导患者和CAR-T产品的选择,以及在治疗过程中监测抗原的表达。
最近报道了几种增加多发性骨髓瘤细胞靶抗原密度的有趣策略。小分子γ-分泌酶抑制剂(GSIs)被证明可以阻止多发性骨髓瘤细胞的BCMA脱落,从而提高抗BCMA CAR-T细胞的疗效。我们已经证明,使用组蛋白去乙酰化酶(HDAC)抑制剂(例如,panobinostat、ricolinostat、下一代HDAC6抑制剂)的表观遗传调节可增强多发性骨髓瘤细胞的CD38表达,从而增强抗CD38抗体的活性,这个概念目前正在多发性骨髓瘤CAR-T细胞靶向抗原上进行测试。
实体瘤:长期以来,人们一直致力于用几种典型靶抗原(例如TAG-72、FR(叶酸受体)、CEA(NCT00004178)、GD2(NCT00085930)、CD171(NCT00006480)和IL13RA2(NCT00730613))来评估实体瘤中的CAR-T细胞的治疗效果。这些试验大多使用的还是与现在的标准相比,技术上不太先进的CAR-T产品和生产工艺。自那时以来,提高疗效的一个方向就是改进载体和制造技术,包括寻找在肿瘤细胞上均质稳定表达的替代靶抗原(理想情况下具有病理生理相关性以降低抗原丢失的风险)。目前,有几种CAR-T细胞产品正在积极的进行临床试验或临床前的后期开发,例如GPC3、mesothelin、HER2、EGFRvIII、ROR1、CD171、B7-H3、整合素αvβ3、硫酸乙酰肝素Glypican-1、N端连接糖表位的Annexin A2、Claudin18.2,肿瘤限制性MUC1的裂解产物MUC1*。
在最近的一项研究中,研究者发现了蝎毒氯毒素(CLTX)的胶质母细胞瘤结合能力,构建了CLTX肽作为抗原结合部分的CAR-T细胞。CLTX-CAR-T细胞靶向依赖于靶细胞上MMP2的表达,并在异种移植模型中诱导肿瘤消退而无毒性反应。此外,还有靶向表达在卵巢癌、睾丸癌和肺癌上的Claudin-6的CAR-T细胞。联合应用编码靶抗原的RNA疫苗纳米颗粒,促进了CAR-T细胞在体内的扩增和植入,从而在同源小鼠模型中导致肿瘤消退。CAR-T细胞也被靶向非经典肿瘤抗原,如PD-L1或纤维结合蛋白剪接变体EIIIB,它们在肿瘤间质和新生血管中表达。
此外,另一个方向是评估CAR-T细胞在联合治疗中的作用,这些联合疗法旨在中和肿瘤微环境(TME)中的抑制机制,并使用先进的基因工程技术来增强CAR-T细胞的效力和寿命。
CAR-T细胞的新技术
提高功效的技术:T细胞衰竭已被确定为限制CAR-T细胞治疗实体瘤疗效的一个主要原因。为了构建抗衰竭的CAR-T细胞,研究人员最近鉴定了关键的转录因子,并显示TOX和NR4A转录因子的缺失以及AP-1家族转录因子c-Jun的过度表达增加了小鼠肿瘤模型中的CAR-T细胞功能。
在TME中,许多抑制因子可能会阻碍CAR-T细胞的功能。通过CAR-T细胞产生抗PD1单链抗体、去掉PD-1和TGF-β受体、抑制TGF-β受体信号通路的抑制和表达主要的负调节TGF-β受体能够对抗这些抑制性配体和可溶性因子,从而增强CAR-T细胞的功能。此外,通过在CAR-T细胞中表达主要的负性Fas受体,可减少来自TME的死亡信号。
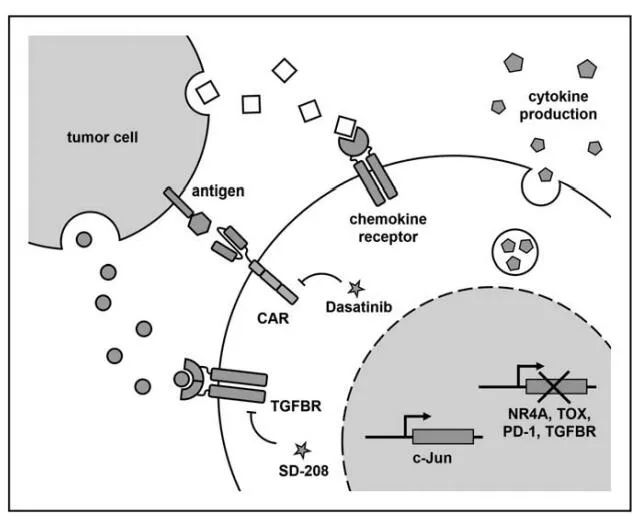
引导CAR-T细胞主动调节TME中的细胞因子环境是另一种增强疗效的有效策略。最近有报道称,使CAR-T细胞产生白细胞介素(IL)15,或IL-15和IL-21或IL-23的联合通过自分泌机制可以提高CAR-T细胞的持久性和抗肿瘤能力。对于产生IL-18的CAR-T细胞或通过溶瘤病毒向肿瘤靶向输送IL-2和TNF-a也观察到类似的效果,两者都具有参与先天性和内源性适应性免疫反应的额外效果。同样,在CAR-T细胞上表达CD40L可以使抗原呈递细胞招募内源性肿瘤靶向T细胞。
CAR-T细胞转移到肿瘤部位的减少可能是由于CAR-T细胞上趋化因子受体的错配和肿瘤中异常表达的趋化因子引起的。因此,为了促进向肿瘤的输送,可以将CAR-T细胞转化为表达与特定肿瘤的趋化因子谱相匹配的趋化因子受体。CCR2b的表达允许CAR-T细胞向表达CCL2的肿瘤迁移。同样,最近的一项研究将IL-8受体表达与CXCR1或CXCR2结合起来,以增加CAR-T细胞的持续性和向肿瘤部位的输送能力。此外,可以想象的是,这些策略中的一些可以结合起来,以“定制”CAR-T细胞产品,以适应每个肿瘤实体的具体情况。
提高安全性的技术:细胞因子释放综合征(CRS)是一种全身炎症反应,也是CAR-T细胞治疗最常见的急性毒性反应。有几个因素会影响CRS的发生率和严重程度,包括肿瘤负荷、CAR-T细胞剂量、体内扩增和淋巴细胞消耗的调节。CRS和神经毒性的临床管理概念继续得到完善,并有助于降低发病率和死亡率。然而,CRS仍然是病人住院和重症监护的主要原因,限制了CAR-T细胞治疗的可用性。
最近的一个重要进展是小鼠模型的发展,这些模型能够再现CRS的临床特征和神经毒性,并被用于从机理上深入了解CRS的病理生理学,并评估干预策略。在NSGSGM模型中,小鼠被植入人类造血干细胞,以提供“内源性”髓细胞,这些细胞在CRS发展的恶性循环中至关重要,并产生CRS主导细胞因子IL-6和IL-1。在这个模型中,使用临床认可的IL-6受体拮抗剂(IL-6RA)可以阻止显性CRS的发展,但未能预防神经毒性。这提供了这样一个假设,即IL-1分泌是CRS发生的关键事件,事实上,IL-1受体拮抗剂anakinra的治疗能够控制CRS,并防止致命的神经毒性。在CD19 CAR-T治疗中使用Anakinra预防CRS和神经毒性的II期研究正在进行中(NCT04148430)。同样,在异种移植小鼠模型中,联合应用抗GM-CSF抗体lenzilumab增强了CAR-T细胞的抗肿瘤活性,减少了CRS和神经炎症。
此外,研究发现酪氨酸激酶抑制剂(TKI)达沙替尼通过阻断LCK干扰CAR信号,诱导CAR-T细胞快速启动功能关闭状态,表现为细胞溶解活性和细胞因子分泌停止。为了证明在体内对CAR-T细胞进行“远程控制”的能力,研究者使用达沙替尼作为药理学关闭开关,以防止小鼠体内细胞因子分泌和CRS的发展。有趣的是,达沙替尼的抑制作用是迅速和完全可逆的,为急性和短暂控制提供了机会,而不终止CAR-T产品,正如触发自杀开关的情况一样(例如诱导型caspase 9),或通过共表达表面标记物(如tEGFR)进行抗体为基础的清除。
另一个最近提出的策略是设计一个包含异二聚体目标识别和信号结构域的刹车结构,这种结构域在使用高亲和力小分子药物时会被破坏。在有药物的情况下,刹车结构是失活的。一个优点是这种小分子药物特异性地针对这种特殊的刹车结构,缺点是这种药物仍然需要经过正式的临床开发和批准。除了短暂的控制毒性作用外,这两种策略还可以协调性地用于防止慢性的CAR信号,这是导致CAR-T细胞衰竭的关键因素。
通过表达考虑多种抗原的“智能”CAR设计,提高CAR-T细胞的能力以区分肿瘤细胞和健康细胞的研究日益增加。一个先进的概念是使用合成notch(SynNotch)受体,该受体包含针对特定靶点的细胞外抗原识别域。靶点连接导致细胞内转录因子的释放,该转录因子迁移到细胞核以诱导次级CAR基因的表达。在最近的一个应用中,B7-H3或EpCAM特异性SynNotch受体被用来诱导ROR1特异性CAR的表达。这项研究显示了提高肿瘤细胞选择性和防止对健康组织毒性的潜力。然而,SynNotch的概念仍然受到notch受体的自发释放和在T细胞表面表达次级CAR的时间延迟的困扰,SynNotch CAR-T细胞的有效性和安全性尚待临床证明。
基因工程与制造技术的提升:最近两个特别值得注意的进展是利用Sleeping Beauty转座系统和CRISPR-Cas9基因组编辑技术改进了无病毒基因转移,使CAR转基因具有针对性的基因组插入。Sleeping Beauty转座酶的设计变体的开发可以通过一个小循环DNA转座子共同转化T细胞,从而促进了无病毒过程中可扩展、快速和可出口的制造。先前的研究已经证明了实现稳定的CAR表达的潜力,并建立了第一个用于Sleeping Beauty CAR-T细胞的临床安全性研究。欧洲首个关于Sleeping Beauty CAR-T细胞的临床试验最近获得批准,并将研究SLAMF7 CAR-T细胞对抗多发性骨髓瘤的疗效(https://www.caramba-cart.eu)。将CAR(和T细胞受体,TCR)转基因靶向插入内源性TCR位点,目的是实现生理性的调节CAR表达以增强反应性和防止耗竭。临床使用CRISPR编辑的T细胞产品的一个关键要求是仔细注释非靶向基因,以评估遗传毒性的风险。
展望
在血液学和肿瘤学适应症中,CAR-T细胞的新靶抗原有着丰富的管线,同时也有新技术来提高CAR-T细胞治疗的治疗指数。有了这个“目标和技术包”,我们有理由预期CAR-T细胞疗法将在其他癌症实体中完成其概念性的临床实践。
参考文献:
New targets and technologies for CAR-T cells. Curr Opin Oncol. 2020 Sep;32(5):510-517.