2019年1月,FDA药品审批与研究中心(CDER)发布了年度报告《创新推进健康:2018年新药审批报告》(以下简称《报告》)。《报告》指出,2018年是创新、进步的又一个强劲的年份,在这一年中,FDA共批准了59种新药,7种生物类似药。这些药物涵盖了罕见疾病、传染性疾病、神经类疾病、心肺和循环系统类疾病、女性健康相关疾病以及癌症和血液疾病。为有需求的患者带来安全、有效的创新疗法,这是FDA批准的宗旨。
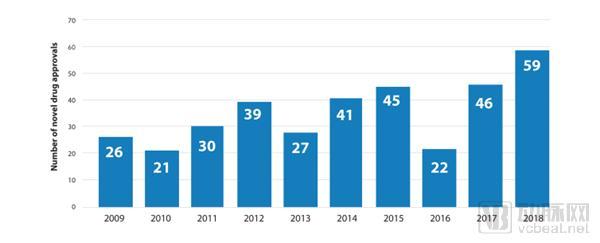
2009-2018年FDA批准新药数量(图片来自FDA官网)
备受FDA关注的肿瘤药物
肿瘤,由于其种类众多、致病原因不一、复发率高,长久以来被认为是无法治愈的疾病。且肿瘤药物大多副作用大,对不同个体的疗效差异也大。近年来,FDA 对肿瘤药物的批准呈稳步上升趋势。在2018年FDA发布的《报告》中,动脉新医药(微信号:biobeat1)发现,FDA批准的肿瘤新药有16种,占比27.12%;
此外,FDA批准了19个首创新药,其中肿瘤新药有4种,占比21%;批准罕见病药物34种,其中肿瘤药物有13种,占比38.2%;获突破性疗法认定药物14种,其中肿瘤药物有4种,占比28.5%;获快速通道药物24种,其中肿瘤药物有6种,占比25%;获优先审评药物43种,其中肿瘤药物有13种,占比30.2%;获加速审评药物4种,其中肿瘤药物3种,占比75%。
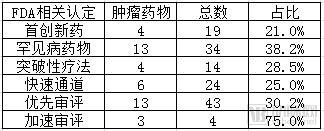
肿瘤药物获FDA相关认定占比图
从这些数据我们看出,获得众多FDA相关认定的肿瘤药物显然是FDA关注的重点所在。且《报告》中还重点介绍了今年生物类似物的审批情况,随着生物制品专利和专营权在美国到期,FDA将预期收到更多的生物类似药申请。在2018年,FDA批准的肿瘤生物类似药有3种,占比42.86%,这另一方面体现了FDA对肿瘤药物的关注。因此,动脉新医药收集整理了这19种肿瘤药物的信息特点,旨在从2018年FDA的审批中,探索上市肿瘤药物的特点和规律。
在批准的16种肿瘤新药中,我们发现了两项值得注意的批准:
1、FDA批准了基于新型终点MFS(无转移生存期终点)的第一个药Erleada。
2、FDA批准了第二个基于肿瘤特征,而不是其体内起源部位的“广谱”肿瘤药物Vitrakvi。
Erleada的获批是使用新型终点加速重要治疗药物进入市场的一个例子。而继Keytruda获批之后,FDA再次批准了基于肿瘤特征,而不是其体内起源位部位的肿瘤药物Vitrakvi。基于这两项批准的新型终点或药物特征是否能应用于国内的创新药审评,还有待考察。
2018年FDA批准的肿瘤新药
Asparlas(培戈卡门冬酶-MKNL),一种长效天冬酰胺特异性酶,L-天冬酰胺是某些肿瘤细胞(包括白血病细胞)赖以生存和繁殖的一种必需氨基酸,通过水解耗竭血浆中的L-天冬酰胺,最终使肿瘤细胞的生长和增殖受到抑制,从而选择性地杀伤白血病细胞,导致细胞死亡。但正常组织细胞自身具有合成L-天冬酰胺的能力,因此不会受到药物影响。
Braftovi(恩考芬尼),一种激酶抑制剂,抑制表达BRAFV600 E、D和K基因突变的肿瘤细胞系的体外生长。与Birimetinib联合用于治疗患有BRAFV600E或V600K基因突变的不可切除或转移性黑素瘤患者,该口服联合疗法已获FDA批准。
Copiktra(度维礼司),该药物是磷酸肌醇3-激酶(PI3K)的口服抑制剂,也是首个获批的PI3K-delta和PI3K-gamma双重抑制剂。FDA批准其用于治疗慢性淋巴细胞白血病(CLL)或小淋巴细胞淋巴瘤(SLL)患者,还授权Copiktra(duvelisib)加速审批用于在经过至少两次治疗后复发或难治性滤泡性淋巴瘤(FL)的成人患者。
Daurismo(格拉德吉),目前第一种、也是唯一获得FDA批准治疗AML(急性髓性白血病)患者的Hedgehog信号通路抑制剂。该药物可与低剂量阿糖胞苷(LDAC)化疗联用,治疗新确诊的75岁及以上、或由于合并症而无法使用高强度诱导化疗的急性髓系白血病(AML)患者。
Elzonris,FDA已批准其用于治疗BPDCN(浆细胞样树突状细胞肿瘤患者),BPDCN是一种侵袭性强的罕见骨髓和血液疾病。Elzonris通过靶向IL-3Rα(CD123)——一种在BPDCN细胞和多种其它血癌细胞上高度表达的蛋白,抑制蛋白合成,从而引发靶标细胞的细胞凋亡。在此批准之前,没有FDA批准的治疗药物。
Erleada(阿帕他胺),第二代高选择性雄激素受体(AR)拮抗剂,与雄激素受体的亲和力是第一代AR拮抗剂的5倍以上,用于非转移性前列腺癌患者的治疗。该药物是首个凭借MFS(无转移生存期)的临床终点获批上市的肿瘤新药。所谓MFS,是指从非转移性肿瘤患者从开始治疗到肿瘤细胞转移至身体其他器官或死亡的时间。
Libtayo,该药物通过阻断细胞通路PD-1(在人体免疫细胞及某些癌细胞发现的蛋白质),帮助人体免疫系统识别、消除癌细胞。FDA已批准其用于治疗转移性皮肤鳞状细胞癌(CSCC)或局部晚期CSCC患者。这些患者不适合治愈性手术或治疗性放射治疗。这是FDA首次批准用于晚期CSCC的药物。
Lorbrena(洛拉替尼),一种ALK酪氨酸激酶抑制剂(TKIs),用于治疗患有ALK+非小细胞肺癌(NSCLC)的肺癌患者,具体为:(1)接受第一代ALK抑制剂Xalkori(Crizotinib,克唑替尼)及至少一种其他ALK抑制剂治疗转移性疾病后病情有进展的患者;(2)接受第二代ALK抑制剂Alectinib(Alecensa,诺华制药)或Certinib(Zykadia,罗氏制药)一线治疗转移性疾病后病情有进展的患者。Lorlatinib为克服先前批准的TKI药物的耐药性提供了新选择。
Lumoxiti (帕西妥莫单抗),一种靶向CD22的细胞毒素,也是用于毛细胞白血病患者的首个药物,用于治疗患有复发性或难治性毛细胞性白血病(HCL)的成年患者。HCL是一种罕见的、生长缓慢的血液癌症。FDA 为这款药物的上市申请授予了快速通道审评、孤儿药认定、优先审评资格。
Lutathera(奥索瑞肽镥),一种Lu-177标记的生长抑素类似物,属于新兴的肽受体放射性核素疗法(PRRT)的一种,通过与一种称为生长激素抑制素受体的细胞结合而起作用。该生长抑素受体可能存在于某些肿瘤上,在与受体结合之后,药物进入细胞,释放辐射来损伤肿瘤细胞。该药物用于治疗一种称为胃肠胰神经内分泌肿瘤(GEP-NETS) 的影响胰腺或胃肠道的癌症。这是首次批准放射性药物、或称为放射药物用于治疗GEP-NETS。在美国和欧盟,Lutathera均被授予孤儿药地位。
Mektovi(贝美替尼),该药物是口服和选择性的 MEK1/2 抑制剂,与Encorafenib联合用于患有BRAFV600E或V600K突变的不可切除或转移性黑色素瘤患者已获FDA批准。
Talzenna(甲苯磺他拉唑帕利),该药物是辉瑞公司研发的PARP抑制剂。这是迄今为止,FDA批准的第4款PARP抑制剂,通过阻断PARP酶的活性,并将PARP酶束缚在DNA损伤位点,导致肿瘤细胞的死亡。FDA批准其用于治疗携带生殖系BRCA突变、HER2阴性的局部晚期或转移性乳腺癌患者。
Tibsovo(艾伏尼布),该药物是一款同类首创的、具有选择性的、针对IDH1基因突变癌症的强效口服靶向抑制剂,已获FDA批准用于治疗有特定“IDH1”基因突变的、患有复发或难治性急性髓性白血病(AML)的成人患者。
Xospata(富马酸吉瑞替尼),FDA批准的针对“FLT3”突变的、用于复发性或难治性AML的首个也是唯一一个FLT3靶向制剂。此前,FDA已授予Xospata孤儿药资格和快速通道资格。








