本文系基于公开资料撰写,仅作为信息交流之用,不构成任何投资建议。
凭借伊布替尼(Imbruvica)和维奈克拉(Venclexta)两大爆款产品,艾伯维成为全球名副其实的“血液瘤之王”。
可在绚丽的光环背后,艾伯维却出现长达七年的血液瘤产品空窗期,第三款血液瘤产品Epkinly在2023年5月才姗姗来迟,此时距维奈克拉上市已经有七年之久。
世人皆知艾伯维正处于“后修美乐”时代,正在极力寻找新的业绩增长点。但少有人知,艾伯维的血液瘤领域遭遇的挑战远比自免领域更大:核心产品伊布替尼遭遇挑战,CAR-T疗法的风口又遗憾错过。强生、诺华、阿斯利康、百济神州都对“血液瘤”虎视眈眈,艾伯维正在竭尽全力地捍卫王座。
自免业务与血液瘤业务双双衰退的情况下,市场并没有正视艾伯维所遭遇的危机。
01“血液瘤之王”如何炼成?
艾伯维的前身是百年历史积淀的雅培,后在2011年独立拆分,并于2013年正式登陆美股市场。
上市之初,艾伯维只能算得上是一家拥有明星大单品修乐美(阿达木单抗)的Biotech公司,市场对它的预期并不高。但让华尔街没有想到的是,上市后的三年时间中,艾伯维居然连续孵化出伊布替尼和维奈克拉这两款重磅血液瘤药物,从而确立了“自免+血液瘤”双主线发展路径。
维奈克拉既是全球唯一获批的Bcl-2抑制剂,也是艾伯维“二十年磨一剑”的重磅自研产品。Bcl-2蛋白是一种抑制细胞凋亡的蛋白,于1983年被首次发现,正是由于它的高表达,才造就了肿瘤细胞顽强的生命力。因此,如果科学家能够有效地抑制Bcl-2蛋白表达,就能引发肿瘤细胞的凋亡,从而发挥抗癌作用。
虽然Bcl-2蛋白的机理已经十分明确,可由于Bcl-2蛋白属于PPI结合(蛋白-蛋白结合),结合界面很大,很难通过设计小分子达到阻断结合的目的。同时,与Bcl-2结合的口袋又比较大,有13~15个氨基酸,因此设计难度也很大。此外,Bcl-2靶点还存在药物输送的问题,进一步增加了成药难度。
极为严苛的成药条件,导致药企在Bcl-2靶点失败连连,而艾伯维之所以成功正是因为解决了这一系列成药问题。
1996年,时任雅培药物研发总监StephenW.Fesik在《科学》杂志发表了一篇关于片段化药物设计(FBDD)的论文,从而找到了全新的解题路径。针对Bcl-2靶点结合面太大的问题,Fesik并没有遵循传统路径,而是通过将结合口袋切割成两个片段的方式破局,只要能够找到与每个片段相结合的小分子,再将他们结合起来,就有望攻克Bcl-2靶点的难题。
于是,艾伯维团队就按照这个思路开始进行研发,可还是在Bcl-2靶点上出现连续失败。艾伯维最先找到的化合物是ABT-737,虽然药学特性不错,但必须注射给药,而且动物模型并不理想,因此最终被遗憾放弃;之后艾伯维又选定了ABT-263,可以同时靶向Bcl-2 和Bcl-xL两个靶点,可惜的是这款药物虽然进入临床,但最终还是因Bcl-xL在成熟的外周血小板中表达,而极容易引发血小板减少的副作用。
两次失败的尝试并没有毁灭艾伯维对于Bcl-2靶点的期待,2007年6月基因泰克也开始加入Bcl-2抑制剂的联合研发,合力选出了ABT-199这个较为完美的化合物,并最终于2016年成功上市。
或许正是因为艾伯维在血液瘤领域的专注,让他们在研发Bcl-2抑制剂的过程中,发现了伊布替尼的价值。2015年5月,艾伯维堵上全部身家,以210亿美元的天价,并购了Pharmacyclics公司,从而将伊布替尼收入囊中。
通过复盘艾伯维的这段历史,投资者不难发现,艾伯维能够成为“血液瘤之王”并非偶然,而是建立在长达二十年的持续研发之上。尽管伊布替尼是资本并购的产物,但敢于以210亿美元的天价去豪赌,这本就是一种认知上的胜利。
02空白的七年
艾伯维的两款血液瘤产品上市后,迅速取得了骄人的销售成绩。
伊布替尼是全球首个上市的BTK抑制剂,已经在血液瘤治疗中扮演基石药物的角色。商业化方面,在艾伯维并购Pharmacyclics公司之前,强生就拿下了伊布替尼的海外权益,因此伊布替尼实际拥有艾伯维和强生两强的商业化渠道。先发优势叠加营销优势,促使伊布替尼上市后迅速放量,其全球总营收也由2014年的6.92亿美元,飙升至2021年的111.68亿美元。
维奈克拉虽然没有伊布替尼这般强势的业绩表现,但其是目前全球唯一获批的Bcl-2抑制剂,因此在2016年上市后同样快速放量,至2023年维奈克拉的营收已经达到22.88亿美元,且仍有希望继续保持高速增长态势。
更为关键的是,作为血液瘤两大核心治疗药物,伊布替尼与维奈克拉之间还产生了协同效应,伊布替尼与维奈克拉联用治疗慢性淋巴细胞白血病疗效显著,艾伯维有望通过两大核心药物建立起一道稳固的血液瘤护城河。

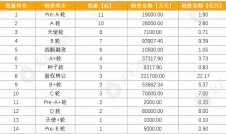
图:艾伯维血液瘤产品纵览,来源:锦缎研究院
然而,尽管两大核心药物增长趋势喜人,但艾伯维却在此后很长一段时间内陷入血液瘤研发真空期。直至2023年5月,FDA才加速批准艾伯维与Genmab共同开发的CD3/CD20双特异性抗体Epkinly用于治疗复发或难治性(R/R)弥漫性大B细胞淋巴瘤(DLBCL)。
作为FDA批准的首款治疗DLBCL的双抗产品,Epkinly的前景被市场寄予厚望,但这却无法掩盖艾伯维血液瘤领域竞争力下降的事实。虽然伊布替尼与维奈克拉依旧是当下最成功的血液瘤产品,但他们却都极有可能面临后来者竞争的问题。
百济神州的泽布替尼、阿斯利康的阿卡替尼均“头对头”战胜了伊布替尼,他们正在快速瓜分伊布替尼的市场份额,尤其是百济神州的泽布替尼增速更是明显领先于竞争对手们。迫于无奈,艾伯维只得通过专利战的方式,意图延缓泽布替尼在美国市场的销售。

图:全球BTK抑制剂竞争格局,来源:锦缎研究院
与之相比,维奈克拉的竞争环境明显更优,其依然是唯一获批的Bcl-2抑制剂。但在这个赛道中,百济神州、亚盛医药、复星医药、诺诚健华全部投入重金研发,其中百济神州、亚盛医药均已进入临床三期,极有可能诞生全球第二款Bcl-2抑制剂。
两大靶点之外,CAR-T疗法可以算得上是近些年最热门的血液瘤疗法手段。诺华、吉利德已经在CAR-T疗法迭代了多代产品,强生也看准机会拿下了传奇生物CAR-T疗法的一半权益,而“血液瘤之王”艾伯维却在CAR-T疗法折戟沉沙,其在2023年终止了与Caribou Biosciences联合开发的两款通用CAR-T产品。
CAR-T赛道的失利只是艾伯维肿瘤领域不得志的缩影。仅2023年中,艾伯维就“退货”了多款肿瘤管线,涵盖ADC、单抗、三款、CAR-T等多个热门领域。由此不难看出,艾伯维管理层对于过去几年肿瘤管线的规划也是难言满意的。

图:2023年艾伯维退货一览,来源:锦缎研究院
不过,艾伯维并未就此放弃CAR-T疗法,今年1月艾伯维与Umoja Biopharma达成总额超过14亿美元的合作协议,两家公司将利用Umoja专有的VivoVec平台,在肿瘤学领域开发多个原位生成的CAR-T药物,这足以说明艾伯维是看好CAR-T赛道未来的,只不过它已经错失了第一波风口。
03悄然开启的艾伯维2.0
喜提2023年“退货王”,这足以表明艾伯维全面转变的决心。管线全面调整背后,实则公司管理层也在进行一次大规模“换血”。
去年4月初,艾伯维中国区总经理欧思朗突然离职。对于欧思朗的离开,行业普遍观点都是较为意外。欧思朗已经在艾伯维中国工作十年,早在2013年艾伯维从雅培拆分的时候,欧思朗就加入艾伯维担任中国区总裁,其一直都是艾伯维中国的实际领导人。
接任欧思朗出任艾伯维中国区总经理的是拥有25年医药行业工作经验的董莉君,她曾担任罗欣药业中国首席运营官,成功地重构了公司的商业化运营团队。从艾伯维中国“话事人”更替的动向看,艾伯维显然是希望从中国区获得更多的业绩增长。
实际上,过往6年艾伯维中国区业务表现亮眼,在2018年时中国区业务营收仅为1.52亿美元,而到了2023年已经增长到9.5亿美元。虽然对于年营收超500亿美元的艾伯维来说,中国区营收依然仅占总营收的1.7%,但高速增长的趋势显然让艾伯维看到了更大的潜力。

图:艾伯维中国区营收情况,来源:锦缎研究院
中国区“换帅”只是艾伯维一系列改变的缩影。今年7月,艾伯维首席执行官 Richard A. Gonzalez正式退休,改由首席运营官Robert A. Michael接任。值得注意的是,Gonzalez同样是执掌艾伯维11年的老臣,他在雅培工作了30年时间,一手策划了艾伯维的独立。
随着欧思朗、Gonzalez等一批“老人”的退出,艾伯维即将迎来一个全新的时代。如果将此前十年划分为艾伯维1.0时代,那么其显然是成功的。依托于爆款药物修美乐,以及两款血液瘤爆款,艾伯维成为全球最炙手可热的创新药明星公司,市值一度达到3500亿美元。
但同时,艾伯维1.0时期的问题也随着时间开始逐渐显现。艾伯维的专利悬崖,血液瘤领域“空白的七年”,都足以表明艾伯维最核心的竞争力实则是有所下降的。虽然公司规模越来越大,但市场对于公司的预期也越来越高,显然公司需要更多改变去适应市场的要求。
如果说艾伯维1.0时代主要解决的是企业如何生存的“打江山”问题,那么艾伯维2.0时代需要解决的就是怎样才能延续增长的“守江山”问题。这对于公司管理层的资本布局,以及营销效率都提出了更高的要求。当然,一系列改变究竟能够取得怎样的结果,这就依然需要时间来给我们答案了。
原文标题 : 血液瘤之王“空白的七年”