前言
双表位双特异性抗体(bpAbs)属于双特异性抗体的一个分支,其结合相同抗原上不同的、不重叠的表位。这种独特的结合模式使之具有了新的作用机制,超越了单特异性的单克隆抗体。双表位结合可以产生更优越的亲和力和特异性,促进拮抗作用,锁定靶标构象,并导致更高阶的靶标聚集。这种抗体-靶标复合物可以引发强烈的激动作用,增加免疫效应器功能,或导致快速的靶标内吞下调和溶酶体运输。这些作用机制不仅对治疗性抗体具有吸引力,而且越来越多地被探索用于其他模式,如抗体偶联药物、T细胞结合器和嵌合抗原受体(CAR)T细胞。在过去的十年里,bpAbs的治疗潜力随着临床试验的首次成功而焕发异彩,这些开创性的分子为当今临床开发中越来越多的bpAbs铺平了道路。
bpAbs的形式
抗体发现和工程化技术的进展催生出越来越复杂的bpAb形式,使其能够在不同的结构中组装,针对不同表位的结合域。bpAb形式的选择取决于靶标的生物学和MoA,关键的设计考虑因素包括靶向表位、单个结合域的数量和性质、半衰期延长和效应器功能,以及确保所有结构域正确组装成功的可能性。

迄今为止,在临床上测试的bpAbs不仅具有不同的形式,而且利用了大量不同的单个结合结构域,例如单域抗体(sdAbs)和单链可变片段(scFv)。首批进入临床的两个bpAbs,ALX-06517和BI1034020,均由串联的sdAbs组成。基于抗体片段的bpAbs通常在循环中表现出较短的半衰期。
目前,在临床上测试的大多数bpAbs具有Fc的结构。四价分子MEDI4276和BAT2022是具有2 + 2分别连接到HC的N-或C-末端的scFvs或sdAb。另一方面,KN060是具有串联sdAb臂且没有LC的对称bpAb。不对称bpAb通常依赖Fc突变来促进bpAb产物的纯化或引导异二聚体的形成。例如,GEN3009是一种具有Fc结构域导向突变的不对称bpAb,可确保两个不同HC的正确配对。
bpAbs的作用机制
与其他抗体相比,与同一靶标上的两个不同的、不重叠的表位结合会导致bpAbs的许多独特特性。
增强亲和力
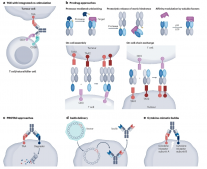
许多bpAbs比它们的亲本抗体显示出更好的结合和较慢的解离。这是与相同(顺式)或不同(反式)靶分子上的两个不同表位结合的结果。与单价或二价单克隆抗体相比,bpAb的解离可能会显著较慢,使其成为高级拮抗剂或反向激动剂。顺式结合形成1:1的bpAb-靶向复合物对于此类应用非常重要,以避免不需要的激动剂活性。

除此之外,表位选择、结合结构域的几何排列、sdAb连接优化和亲和力调节对于实现所需的MoA和最大化功效至关重要。最后,对靶标亲和力的仔细调节,有助于减少靶向毒性。例如ISB1442的抗CD47 Fab被设计用于弱亲和力,以实现与CD47阳性红细胞的最小反应性;而高亲和力、双表位抗CD38臂能够实现对CD38低表达肿瘤细胞的高特异性。
双通路抑制
与两个不重叠的表位结合可以解锁bpAbs的独特活性。例如双通路抑制。例如靶向低密度脂蛋白受体相关蛋白6(LRP6)的bpAb,可以同时阻断Wnt1-和Wnt3a介导的β-连环蛋白信号通路,尤其是在没有激动剂活性的情况下。

另外,bpAb可以通过物理约束使其靶标失活。例如靶向CD38的双表位双抗TNB-73,被证明通过将细胞外结构域锁定在催化失活状态而起到酶抑制剂的作用。

形成免疫复合物
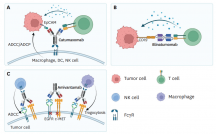
bpAbs的一个独特特征是它们能够通过在反式中同时接合两个不重叠的表位来形成高阶免疫复合物。靶标交联是多种MoAs的基础,包括增强的激动活性、Fc介导的效应器功能或可溶性靶标的清除以及受体下调。

bpAbs的聚集作用可以促进激动活性,特别是对于依赖交联进行有效下游信号传导的受体。例如,针对肿瘤坏死因子受体超家族(TNFRSF)成员OX40和死亡受体5(DR5)的四价bpAb实现了强大的内在激动活性。双侧靶向是引发强效激动剂的必要和充分条件。

此外,bpAbs的受体聚集增加了Fc结构域的局部浓度,从而可以改善效应器功能。交联受体也已被证明可以快速内化并运输到溶酶体,从而导致靶标的快速下调。
克服耐药性机制
治疗病毒感染的一个常见挑战是找到一种广泛中和的抗体,它能结合外壳蛋白的保守区并产生持久的反应。相比于单克隆抗体,bpAb在这方面展现出明显的优势。例如针对SARS-CoV-2的双表位特异性抗体,BAT2022,被证明可与所有主要的变异毒株结合。此外,预防耐药性的多靶向治疗也可用于肿瘤相关抗原(TAA)的靶向治疗。例如,双表位CAR-T细胞可以通过同时靶向两个表位来防止肿瘤逃逸。
bpAbs的临床开发进展
到目前为止,大多数bpAb被开发用于肿瘤治疗,第一种基于bpAb的细胞疗法cilta-cel已被批准用于治疗复发和难治性的多发性骨髓瘤。此外,许多其他bpAb目前正在进行血液肿瘤的早期临床试验,包括ISB 1442和OriCAR-017,它们都处于治疗复发性/难治性骨髓瘤的I期临床阶段。

对于实体瘤的治疗,许多bpAbs靶向HER2。分别与非重叠结构域IV和II结合的临床单抗曲妥珠单抗和帕妥珠单抗组合靶向两个不同的HER2表位,先前已被证明可显著改善治疗结果和预后。HER2的重要性和双表位靶向的临床先例推动了抗HER2 bpAbs的开发,包括anbenitamab和zanidatamab,这两种临床上最领先的HER2靶向bpAbs。
除了肿瘤学,传染病也是bpAb的主要应用领域。针对一个以上表位的中和抗体,如针对COVID-19的BAT2022和针对艾滋病毒的三联抗体SAR441236,可以克服单一突变逃逸变体的出现,从而实现广泛和更持久的患者反应。
此外,bpAbs越来越多地作为ADC的一部分用于有效载荷递送,因为它们独特的MoAs促进内化和溶酶体运输。目前有六种双表位ADC正在进行临床评估。
小结
bpAbs由单特异性单克隆抗体的组合演变而来,已于2022年通过FDA批准的第一种基于bpAb的疗法证明了其临床安全性和有效性。与传统单抗或双抗,甚至单抗组合相比,bpAbs提供了独特的MoAs。双表位结合所实现的亲和力可以实现高选择性的肿瘤靶向,双表位结合还可以改善受体激动作用、效应器功能和/或有效的内化和溶酶体运输。基于这些独特的作用机制,bpAb可以应用于多种疾病领域和适应症,包括癌症、传染病。事实证明,bpAbs具有巨大的靶向治疗潜力。
参考文献:
1.Biparatopicantibodies: therapeutic applications and prospects. MAbs. 2024 Jan-Dec;16(1):2310890
原文标题 : 双表位双特异性抗体的治疗应用及前景