前言
迄今为止,与传统的抗癌治疗策略相比,免疫治疗被认为是最有前景的全身性肿瘤治疗方法,其中,单克隆抗体因其特异性靶向分子的能力,已成为癌症治疗中一种关键而有效的治疗方式。然而,由于肿瘤复杂的疾病发病机制,针对单一靶点的单克隆抗体往往不足以表现出足够的治疗效果。因此,针对多个靶点的双特异性抗体(bsAbs)应运而生。
与单特异性的单克隆抗体相比, bsAbs是一类可以介导新的作用机制的抗体。2014年,首个靶向CD19/CD3ε的双特异性T细胞接合器(BiTE)blinatumomab被FDA批准用于治疗急性淋巴细胞白血病(ALL)。自那时起,bsAbs掀起了一阵开发热潮。截至2020年底,有三种bsAbs(catumaxomab、blinatumomab和emicizumab)获得批准。尤其最近几年,3年中新增了11种bsAbs获得了监管机构的批准,其中9种被批准用于治疗癌症(amivantamab, tebentafusp,mosunetuzumab, cadonilimab, teclistamab, glofitamab, epcoritamab, talquetamab,elranatamab) ,2种用于非肿瘤适应症(faricimab, ozoralizumab) 。

值得注意的是,其中emicizumab和faricimab,已经取得了轰动性的地位,显示了这类新型疗法的前景。在接下来的关键十年,bsAb有望在血液系统恶性肿瘤、实体瘤和非肿瘤适应症中获得更多的批准,使bsAbs成为治疗药物的重要组成部分。
bsAb的模式
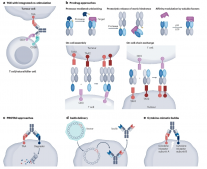
抗体由四条多肽链组成,分子量较大的两条链称为重链(H链),而分子量较小的两条链称为轻链(L链)。在单抗中,两条H链和两条L链的氨基酸组成完全相同,而双特异性抗体的开发是通过共表达两条不同的H链和两条不同的L链。从10种可能的H2L2重组混合物中获得功能性双特异性抗体是双特异性抗体开发的最初挑战之一,这通常称为链相关问题。
在过去几十年里,研究者们已经开发了许多策略,以解决这一问题。由这些策略诱导的不同设计特征或功能特性可用于所产生的双特异性抗体模式的分类。

基于片段的模式(Fragment-based formats)
基于片段的双特异性抗体简单地将多个抗体片段结合在一个分子中,不含Fc区域(fragment crystallizable,可结晶片段,与抗原结合片段Fab相对),避免了链相关问题,优势是产量高、成本低;缺点是半衰期相对较短。此外,基于片段的双特异性抗体可能会出现稳定性和聚合问题。
对称模式(Symmetric formats)
对称模式的双特异性抗体保留了Fc区域,更接近于天然抗体,但在大小和结构上有所不同。这些差异可能对与天然抗体相关的有利特性(如稳定性和溶解度)产生负面影响,从而可能损害这些双特异性抗体的理化和/或药代动力学特性。
不对称模式(Asymmetric formats)
大多数不对称模式的双特异性抗体与天然抗体非常相似,被认为具有最低免疫原性的潜力。不过,解决链相关问题可能涉及到的复杂工程可能会抵消一些不对称模式双特异性抗体的这一优势。
bsAb的作用机制
根据其功能机制,BsAb可分为4类:结合同一抗原的两个表位、细胞-细胞接合器、双功能调节剂和细胞治疗中的BsAb。其中,T细胞接合器是临床研究中应用最广泛的形式,已被证明能诱导肿瘤特异性免疫细胞激活。
结合同一抗原的两个表位
人们已经开发了同时针对同一靶抗原内2个不同表位的双副表位抗体。例如,靶向癌胚抗原(CEA)或VEGF2的bsAb被开发用于治疗癌症。人们还开发了几种bsAb来中和病毒抗原,例如,针对HBV表面抗原和HIV-1包膜蛋白的bsAb显示出针对同源抗原的中和活性。
细胞接合器
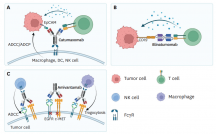
细胞接合器连接两种不同类型的细胞,主要是肿瘤细胞和T/NK细胞,以诱导肿瘤细胞溶解。细胞接合器由TAA靶向部分和效应细胞识别部分组成,并进一步分为T细胞接受器和NK细胞接受器。
T细胞接合器利用TAA和TCR成分(主要是CD3),它们连接肿瘤细胞和T细胞,绕过TCR-MHC-I相互作用。因此,无论抗原特异性如何,T细胞结合器都会触发T细胞活化,产生包括穿孔素和颗粒酶在内的细胞毒性分子,以杀伤肿瘤细胞。
BiTE是T细胞结合器的一种形式,通过靶向TAA和CD3的单链抗体将肿瘤细胞和T细胞结合,用于T细胞介导的肿瘤细胞杀伤。靶向CD19和CD3的blinatumomab是临床上典型的BiTE,2014年,blinatumomab成为第一个被FDA批准的BsAb,用于治疗ALL患者,在随后的几年里,blinatumomab的治疗范围进一步拓宽,2018年,FDA批准其用于首次或第二次完全缓解后MRD≥0.1%的pre-B ALL患者群体的治疗。目前,超过60例BiTE形式的双抗正在进行I/II期临床试验。
NK细胞接合器将CD16A+NK细胞重定向至肿瘤细胞,诱导NK细胞活化。与BiTE相比,NK细胞接受者表现出较少的不良反应,如细胞因子释放综合征(CRS)和神经毒性。多种细胞毒性受体可激活NK细胞:CD16(FcγRIII)、天然细胞毒性受体(NCR;NKp30、NKp44、NKp46)、C型凝集素样受体NKG2D(CD314)和CD94/NKG2C。最近,抗CD30×CD16A的NK细胞接合器(AFM13)在AACR 2022的报告中展示了不俗的抗肿瘤效果。
双功能调制剂
双功能调节剂同时结合两种不同的免疫共刺激或共抑制分子,诱导靶细胞的功能改变。大多数双功能调节剂靶向PD-1/PD-L1轴和其他免疫抑制分子,如CTLA-4(CD152)、TIM-3、LAG-3或TIGIT。MEDI5752(PD-1×CTLA-4)抑制PD-1+激活的T细胞中CTLA-4的功能,诱导PD-1的快速内化和降解。与PD-1和CTLA-4单抗联合治疗相比,MEDI5752的活性显著增强。针对其他检查点分子的双功能性抑制剂,包括LAG-3和TIGIT,也正在开发中。
过继细胞治疗中的bsAbs
尽管CAR-T细胞疗法在血液系统恶性肿瘤中显示出疗效,但也观察到了副作用,包括CRS、神经毒性和靶向非肿瘤效应。为了将不良反应降至最低,正在进行用BsAbs体外激发T细胞的研究。与单独的BsAb和T细胞输注相比,在体外BsAb武装的T细胞治疗可诱导强烈的抗肿瘤反应,有效渗透到肿瘤部位,并减少细胞因子的释放,从而将系统不良反应降至最低。
OKT3×hu3F8 BsAb武装T细胞(GD2BATs)在体外诱导特异性杀伤GD2阳性神经母细胞瘤和骨肉瘤细胞系。在GD2阳性肿瘤患者的I期试验中,GD2BATs在一些患者中显示出临床反应,且无明显副作用。
bsAb的未来展望
在未来的十年里,预计还会批准更多具有改变医疗实践潜力的bsAbs。在肿瘤学中,靶向不同细胞表面受体的分化型双RTK信号抑制剂的开发仍然是一个活跃和先进的临床研究领域。例如靶向EGFR/LGR5的 petosemtamab、靶向HER2/HER3的zenocutuzumab以及靶向HER2双表位的zanidatamab,这几个正在美国进行审评中。这方面需要关注的另一个非常重要的领域是使用bsAbs产生的双特异性抗体偶联偶联物(bsADC),一些bsADC正在后期临床试验中进行研究,包括靶向HER2的zanidatamb zovodotin(ZW49)以及具有靶向c-MET双表位的REGN5093。
开发用于治疗不同血液系统恶性肿瘤的TCE仍将是双抗治疗的主要研究领域,因为这类疗法已经证明了其临床益处。目前,基于不对称1 + 1 形式的odronextamab(CD20/CD3ε)80和 linvoseltamab(BCMA/CD3ε)正在接受审评,可能会在2024年获得批准、其它各种TCE正在NHL、多发性骨髓瘤和AML等适应症中进行后期临床开发。重要的是,新出现的数据也支持了TCE未来也可能在实体瘤中获得更的广泛应用。
bsAb另一个主要研究领域仍然是开发双靶向免疫检查点抑制剂,例如PD-1和CTLA-4或LAG-3(tebotelimab)。这些双检查点抑制剂中的目前正在进行后期临床试验,结果将显示,与PD-1/PD-L1单克隆抗体与CTLA-4或LAG-3的联合用药相比,它们在疗效和安全性方面是否优越。值得注意的是,双靶向PD-1/VEGF抑制剂ivonescimab目前正在接受中国国家药品监督管理局的审评,用于治疗NSCLC。
最后,鉴于bsAbs的多功能性和介导全新MOAs的潜力,bsAbs领域有望看到更多新兴的方法和候选药物进入临床,有望在未来几年提供肿瘤学和非肿瘤学适应症的关键数据,包括在感染/病毒学、自身免疫、代谢、神经病学和眼科的应用。这些新概念包括包括:1)不同于TCE的效应细胞接合器,例如髓系细胞、NK或γδ-T细胞, 2)前药概念,以肿瘤或肿瘤微环境特异性原位激活的bsAbs, 3)联合膜蛋白内化和降解的PROTAC样bsAb, 4)基于抗体的细胞因子模拟物,以触发细胞因子受体,以及 5)将bsAbs递送跨越屏障(如血脑屏障)的独特解决方案,其可用于治疗神经退行性疾病和其他疾病。
参考文献:
1.Development of Bispecific Antibody for CancerImmunotherapy: Focus on T Cell Engaging Antibody. Immune Netw. 2022 Feb; 22(1): e4.
2. Apivotal decade for bispecific antibodies?. MAbs. 2024 Jan-Dec;16(1):2321635.
原文标题 : 双特异性抗体关键的十年