引言
2024年3月,全球批准多款新药上市。FDA批准14款新药(NDA/BLA),包含4款新获批的新分子实体药物(NDA:Type 1 - New Molecular Entity),4款生物制品药物(BLA);NMPA批准3个品规(2个品种)创新药上市,其中2个品规(1个品种)化药,0个品规(0个品种)生物制品,1个品规(1个品种)中药。
01
美国FDA批准情况
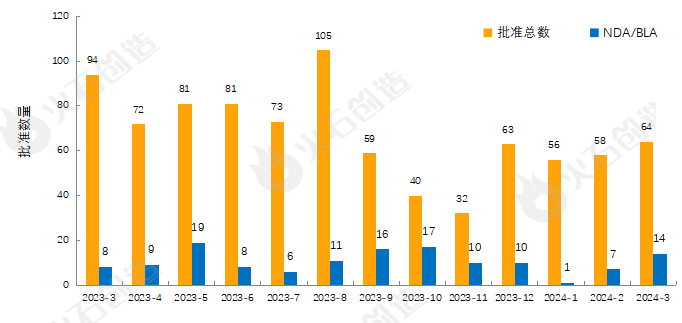
图1 2023年3月—2024年3月FDA药物批准数量变化情况
来源:火石创造产业数据中心
如图1,截至2024年4月11日FDA官网披露,2024年3月FDA共完成64项药品首次批准(不包含暂时批准),其中NDA/BLA批准14款(不包含暂时批准),见表1。其中包括4款新获批的新分子实体药物(NDA:Type 1 - New Molecular Entity),4款生物制品药物(BLA)。
其中JUBBONTI是FDA批准的首个可互换的地舒单抗生物仿制药;
TEVIMBRA(替雷利珠单抗)为百济神州研发的PD-1抗体,用于治疗既往经化疗后进展的晚期或转移性食管磷状细胞癌(ESCC);
REZDIFFRA是第一个也是唯一一个获得 FDA 批准用于治疗非酒精性脂肪性肝炎(也称为“MASH”)的药物;
TRYVIO是一种内皮素受体拮抗剂,用于治疗与其他降压药联用仍不能充分控制的高血压,是目前首款也是唯一一款内皮素受体拮抗剂,是近30多年来首个获批通过新治疗途径发挥作用的口服抗高血压疗法;
DUVYZAT本次获批用于治疗六岁及以上患者的杜氏肌营养不良症(DMD),是第一个被批准用于治疗所有 DMD 基因变异患者的非甾体药物;
OPSYNVI单片剂组合疗法用于长期治疗世界卫生组织(WHO)功能分级为II-III级的肺动脉高压(PAH)成人患者,是第一个也是唯一一个用于肺动脉高压患者的每日一次单片联合疗法;
WINREVAIR也获批用于治疗成人肺动脉高压(PAH,WHO第1组),是第一个获得FDA批准的PAH激活素信号抑制剂疗法,代表了一类新的疗法,它通过改善促增殖和抗增殖信号传导之间的平衡来调节PAH的血管细胞增殖。
表1 2024年3月FDA批准NDA/BLA药物
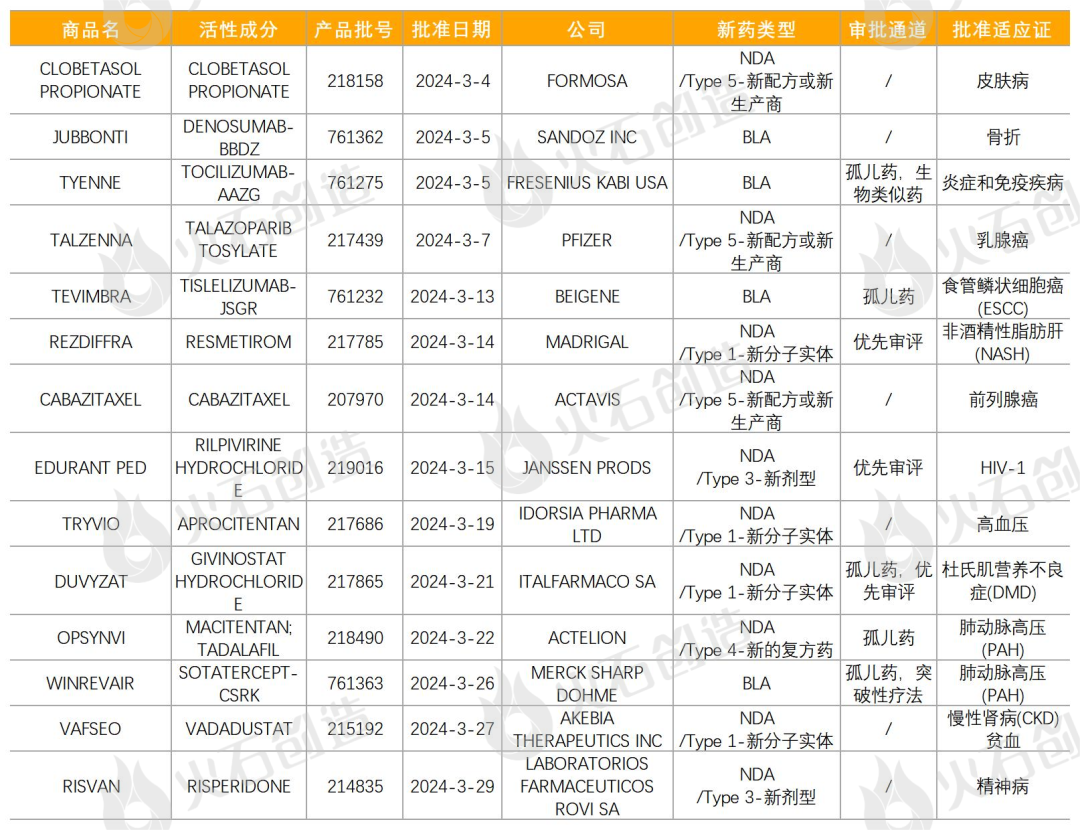
来源:火石创造产业数据中心
02
NMPA批准情况
截至2024年4月11日NMPA披露,2024年3月共批准国产首次注册药品142件。按剂型去重后,共86个药品品种(不同厂家生产同一药物按同一品种计算)。本月有3个品规(2个品种)1类创新药获批,其中2个品规(1个品种)化药,0个品规(0个品种)生物制品,1个品规(1个品种)中药。2024年3月NMPA批准的1类创新药情况见表2。
表2 2024年3月NMPA批准的1类创新药
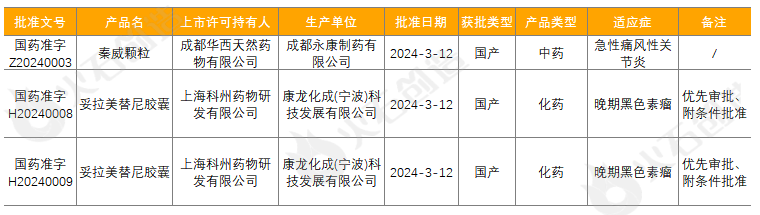
来源:火石创造产业数据中心
成都华西天然药物有限公司申报的中药1.1类创新药秦威颗粒,清热除湿祛风、活血通络止痛,用于急性痛风性关节炎风湿郁热证的治疗,症见关节疼痛、关节肿胀、关节局部发热、口渴喜饮等。该药品的上市为急性痛风性关节炎患者提供了又一种治疗选择。
上海科州药物研发有限公司申报的妥拉美替尼胶囊,通过优先审评审批程序附条件批准上市,适用含抗PD-1/PD-L1治疗失败的NRAS突变的晚期黑色素瘤患者。该药为首款我国自主研发的MEK抑制剂、全球首个且唯一获批针对NRAS突变晚期黑色素瘤适应症的MEK抑制剂,且关键II期注册研究ORR为34.7%,具有同类最佳潜力,在2023版CSCO黑色素瘤诊疗指南,妥拉美替尼作为晚期NRAS突变黑色素瘤治疗的I级推荐。
03
仿制药一致性评价情况
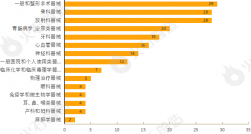
截至2024年4月11日CDE官网披露,CDE共承办药品一致性评价受理号5642个,2024年3月共新增承办55个受理号。截至2024年4月11日,共8053个品规上市药品通过一致性评价(包含视同通过3989个品规),本月共76个品规的药品通过一致性评价(包含视同通过21个品规),按剂型去重后,共51个药品品种。
目前一致性评价品种通过的注射剂共3383个品规(367个品种),本月过评药品中共计47个品规(28个品种)的注射剂。2023年3月至2024年3月通过一致性评价数量见图2。
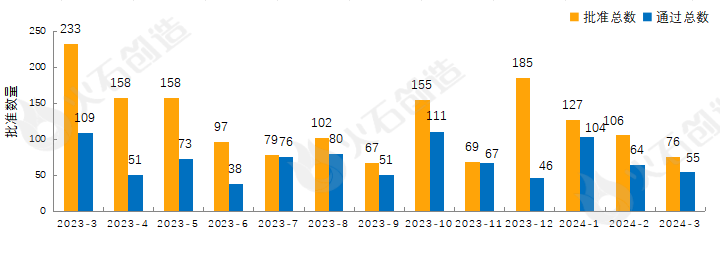
图2 2023年3月—2024年3月仿制药一致性评价批准数量变化情况
来源:火石创造产业数据中心
—END—
作者 | 火石创造 吴雯雯 审核 | 火石创造 殷 莉
原文标题 : 2024年3月全球医药创新成果进展