12月8日,注定是载入基因疗法史册的一天。
当日,FDA正式批准福泰制药与CRISPR Therapeutics共同研发的基因编辑药物Casgevy上市。
这意味着,CRISPR基因编辑疗法获得了全球医药监管标杆的认可,为其后续全球推广奠定了扎实的基础。
Casgevy的上市,再一次体现了FDA坚守的原则——引领创新药潮流,解决临床未满足需求。
在临床上,尽管CRISPR基因编辑疗法是否存在安全性问题仍有争议,但即便如此,FDA依然顶住压力批准上市,再次释放鼓励创新的信号。
同一天,FDA还向市场释放了另一种信号。Casgevy上市的当天,bluebird bio的基因编辑疗法Lyfgenia同样获批,且适应症与Casgevy具有重合性。
为两种不同基因疗法之间的竞赛打响了发令枪,FDA的“阳谋”显而易见:鼓励创新,更鼓励竞争。
这对药企来说,并非好事。FDA鼓励竞争,或许意味着价格战难以避免,一方有可能会因为性能差距导致“上市”即“丧势”。
Casgevy、Lyfgenia同时上市,残酷的博弈已经开始。也正因此,不管是bluebird bio还是CRISPR Therapeutics,都上演“批了=崩了”的惨案:
前者股价暴跌40%,后者股价跌幅也接近10%。
相比于基因编辑的历史性时刻,FDA的“阳谋”,或许是更多药企需要关注之处。
/ 01 / Casgevy:基因魔剪新时代
Casgevy吸引市场的关注点在于,其是基因编辑的新时代产物。
十年前,CRISPR-Cas系统的诞生,让基因编辑从直板机步入智能机时代。相比此前的ZFN、TALENs基因编辑技术,CRISPR-Cas系统有三大显著优点:操作简单、精准度高、花费便宜。
面世以来,该技术已在全球无数生物实验室落地开花,在医学领域有着极高的潜力。
全世界有超过7000种罕见病,病患人数超过3亿人,其中80%是单基因突变造成的。而目前95%的罕见病仍没有有效的治疗药物。
利用基因编辑技术,对发生突变的单个碱基进行剪断、加入或替换等修正操作,就极有可能挽救罕见病人的生命,还他们健康。
理论上,任何突变的基因都可以通过CRISPR-Cas系统纠正。而Casgevy,正是该技术的第一次落地。
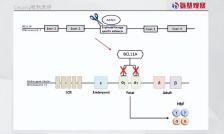
Casgevy的核心机制,是借助CRISPR基因编辑手段,改造患者自身的造血干细胞,让细胞能产生高水平的胎儿血红蛋白。
通常来说,胎儿血红蛋白只会在胎儿发育过程中产生,出生后它的表达通路会被关闭。但某些特殊案例显示,当BCL11A基因突变时,一些成年人也能生成胎儿血红蛋白。
Casgevy做的就是模拟这种突变,对患者造血干细胞的BCL11A进行切割,松开胎儿血红蛋白的刹车。这也使得,Casgevy具有治疗镰状细胞病的潜力。
镰状细胞病是一种遗传性血液疾病,基因突变导致红细胞形成“镰刀”形状。这些细胞会限制向身体输送氧气并阻碍血液流动,导致剧烈疼痛或血管闭塞危象。
目前,在镰状细胞病的临床试验中,共45名患者接受了Casgevy治疗。其中29名的患者数据显示,28例在治疗后至少12个月内,没有出现严重疼痛迹象。
基于亮眼的临床数据,2023年11月16日,英国正式批准福泰制药与CRISPR Therapeutics共同研发的基因编辑药物Casgevy上市申请。由此,Casgevy成为全球第一个上市的CRISPR基因编辑疗法。
如今,Casgevy获得FDA认可,意味着基因魔剪新时代的正式开启。
/ 02 / Lyfgenia:bluebird bio的再续辉煌
相较于Casgevy,Lyfgenia则是完全不同的解题思路。
从根本上来说,镰状细胞病是由珠蛋白的β基因突变引起。人类的血红蛋白是由两条α链和两条β链组成的,四条链缠绕构成血红蛋白的空间构象。
当患者的β肽链上位于第六位的位氨基酸放生改变时,会产生由谷氨酸被缬氨酸代替的现象,此时会构成镰状的血红蛋白HbS,而正常的血红蛋白HbA则被取代,最终引发严重问题。
Lyfgenia解题思路,是将改良形式的β-珠蛋白基因(βA-T87Q珠蛋白基因)的功能,拷贝添加到患者自身的造血干细胞中。
一旦患者具有βA-T87Q珠蛋白的基因,他们的红细胞便可以产生抵抗血红细胞镰刀化的血红蛋白,从而降低镰状血红蛋白的比例。
从临床数据来看,Lyfgenia也展现出极强的战斗力。
在一项单臂研究中,Lyfgenia帮助32名患者中的28名(88%) 在治疗后,6至18个月内完全未出现任何严重疼痛迹象。
在即将举行的美国血液学会年会上,研究人员将展示的新数据显示,接受 Lyfgenia治疗的33 名患者中有30名(90.9%)在此期间严重疼痛迹象完全消退,32 名(97%)没有严重的疼痛迹象。
正是基于突出的表现,Lyfgenia获得了FDA批准。而对于bluebird bio来说,Lyfgenia也是其离体基因疗法第三次获得FDA批准,是辉煌的延续。
只是,不管是Lyfgenia还是Casgevy,难免都要有“既生瑜何生亮”的感叹。
/ 03 / 残酷的竞赛已经开始
虽然上述两款基因疗法的临床数据都足够优异,但均只是单臂研究,因此并不足以向市场证明谁更好。
在FDA批准之前,Leerink Partners对33名美国医生进行的一项新调查显示,超过60%的治疗SCD的血液学家认为,这两种基因疗法在安全性和有效性方面没有重大差异。
当被问及他们会使用哪种上市基因疗法时,40%的人无法决定,而1/3的人选择了Lyfgenia。
这也意味着,在上市第一天,两款疗法的博弈就已经开始。
对于Casgevy来说,劣势不容忽视。
首先,是潜在的安全性问题。如果CRISPR基因编辑技术对预期靶标以外的其他DNA片段进行了切割,可能会破坏非靶向基因的功能或调节,引发严重后果。
为了确定Casgevy脱靶的分析是否可靠,FDA不久前还召集了智囊团开会表决。虽然在会议上,专家小组对该药物的安全性表示肯定,但仍需要药企后续更长周期的临床数据来证明。
其次,则是商业化层面不占优势。基因编辑的治疗极为繁琐。例如,Casgevy首先需要通过从患者的骨髓中取出干细胞,并在实验室中编辑细胞然后进行回输。在回输之前,还要消除掉骨髓中原本的天然造血干细胞,以减少后续异常血红蛋白的表达,并为新造血干细胞的生长留出空间。在回输之后,患者可能需要在医院观察至少一个月,以避免潜在的感染等问题。
因此,对于Casgevy来说,需要在后续的商业化过程中加速对医生群体进行教育。而Lyfgenia的治疗虽同样繁琐,但由于bluebird bio此前有类似药物上市,因此具备成熟的销售渠道,放量或许更占优势。
也正因此,Casgevy最终打出了低价策略:220万美元一针,而Lyfgenia的价格则是达到了310万美元。
当然,对于Lyfgenia来说,也有肉眼可见的安全性bug。Lyfgenia的临床试验先前报告了治疗后出现的急性髓系白血病病例。
相比于Casgevy的潜在担忧,Lyfgenia可能致癌的问题是明确的,因此FDA给其打上了黑框警告。在Casgevy没有黑框警告的情况下,Lyfgenia的推广将会极为被动。
所以,即便最终定价占据优势,但bluebird bio的股价跌幅超过40%。
/ 04 / 总结
制药的目的是为患者服务。因此,FDA在鼓励创新方面,往往具有极强的包容性。但在包容的同时,FDA也体现了其睿智的一面:引入“鲶鱼”,让药企主动内卷。
对于药企来说,这并非一个好消息。从基因疗法的竞争中,我们也能进一步感受到,技术的创新只是手段,选择适合的患者、适合的适应症,确保药物的有效性、安全性,才是创新药企的最高使命。这也是药企真正的立身之本。
原文标题 : 一天两款基因疗法上市,FDA的“阳谋”