前言
CrossMab技术于2011年被开发出来,这种方法能够使双特异性抗体中的抗体轻链与其各自的重链正确结合。与基于ScFV或Fab构建的格式相比,CrossMab的方法在生产、稳定性、可开发性和多功能性方面显示出多种优势。自最初的研究以来,CrossMab技术在过去十年中已发展成为该领域最成熟、最通用和应用最广泛的技术之一,近20种基于罗氏和其他公司开发的CrossMab技术的双特异性抗体已进入临床试验。其中最领先的是目前正在接受监管审查的Ang-2/VEGF双特异性抗体faricimab,以及目前处于关键阶段3期试验的CD20/CD3 T细胞导向双特异性抗体glofitamab。
CrossMab的结构
目前,双抗是肿瘤免疫治疗研究最火热的领域之一。人们已经开发出了产生双特异性抗体的多种方法,一些最广泛应用的技术包括ART-Ig、BEAT、BiTE、共享轻链、DAF、 DART、DuoBody、DutaFab、DVD-Ig、Fab臂交换、Fcab、FORCE、Hetero-Ig、IgG-scFv,κλ-bodies、Tandab、XmAb、VELOCI-Bi和WuxiBODY等。
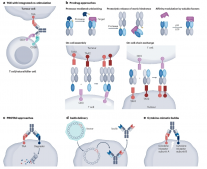
CrossMab技术,在Knobs-into-holes(KiH)方案的基础上,进一步解决了轻链错误联结的问题,简单的说,该技术首先在Fc区设计了KiH异源二聚体连结,同时将Fab区域的CH1和CL互换,以减少轻链错配,如下图。

这种设计原则不仅适用于异二聚体抗体,即其中一个臂指向第一个抗原,另一个臂指向第二个抗原(1+1格式),而且CrossMab技术还允许产生所谓的MonoMab(具有一个Fc部分的单价抗体)和DuoMab(具有两个Fc部分的二价抗体)。此外,它还可用于实现异源/同二聚体双特异性/多特异性抗体附加或串联Fab格式中的正确轻链结合,例如2+1、2+2、3+1、4+1或4+2以及抗体融合蛋白。

CrossMab在肿瘤治疗领域的应用
自crossMab这项技术诞生以来,在过去十年中已发展成为双抗领域中最成熟和应用最广泛的技术之一。截至2021年年中,至少有19种基于罗氏和其他公司开发的CrossMab的双特异性抗体和融合蛋白已进入临床试验,其中16种仍在进行中的临床试验中进行评估。

2012年,第一批进入临床试验的CrossMab是异二聚体1+1结构的靶向VEGF/Ang-2的vanucizumab(RG7221)。vanucizumab在各种临床前模型中表现出有效的抗肿瘤和抗血管生成作用。在1期临床试验中,作为单一疗法,Vanucizumab具有良好的耐受性,并显示出良好的抗肿瘤疗效、低免疫原性和预期的药效学作用机制。
然而,在随机McCAVE的 2期临床研究中,在未经治疗的转移性结直肠癌患者中,与贝伐单抗联合FOLFOX-6化疗进行比较,未能表现出显著优势,临床开发也被中断。类似地,尽管有很好的临床前数据,vanucizumab与PD-L1抗体atezolizumab(NCT01688206)和CD40抗体selicrelumab(NCT02665416)联合使用的1b期研究也最终停止。
在大多数实体瘤中发现成纤维细胞活化蛋白(FAP)在肿瘤成纤维细胞上的表达,使FAP成为肿瘤靶向的有吸引力的抗原。第一个进入1期临床试验的条件性FAP靶向TNFR激动性抗体是对称四价C末端融合的FAP/DR5靶向2+2的crossMab RG7386。临床前数据表明,RG7386有效地触发了FAP依赖性、亲和力驱动的DR5超聚集和随后的肿瘤细胞凋亡,但在完成第1阶段研究(NCT02558140)后,RG7383的临床开发因投资组合重定优先级而无法继续。
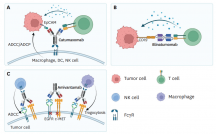
在过去的十年中,随着肿瘤免疫治疗和检查点抑制剂抗体的出现,用于免疫治疗的双特异性抗体的开发已经引起了极大关注。在此背景下,设计了基于双特异性1+1的crossmAb靶向PD-1/TIM-3或PD-1/LAG-3的双检查点抑制性双抗。这两种双抗PD1-TIM3(RG7769)和PD1-LAG3(RG6139)目前都处于1期和2期临床试验(NCT03708328、NCT04140500、NCT04785820)阶段。
罗氏第一个进入临床试验的T细胞导向双特异性抗体是异源二聚体和三价的CEA/CD3ε 2+1 TCB cibisatamab(RG7802)。它是在1+1格式的基础上,将单个额外的靶向CEA的Fab融合到knob重链的N末端,由于亲和力的调节,使得肿瘤细胞和正常细胞之间能够更好地区分。Cibisatamab目前正在与PD-L1抗体atezolizumab(NCT03866239)和FAP-4-1-BBL(NCT04826003)联合进行1b期临床试验。
目前,最领先的2+1 T细胞导向双特异性抗体是glofitamab(RG6026),靶向CD20和CD3ε。glofitamab目前正在淋巴瘤患者的多个临床试验中进行评估,包括CAR-T细胞治疗后复发患者的试验(NCT04703686)和复发/难治性弥漫性大B细胞淋巴瘤患者的3期临床试验(NCT04077723,NCT04408638)。其他类似2+1 的T细胞导向双特异性抗体大多在临床1期阶段,包括用于治疗多发性骨髓瘤的BCMA-TCE CC-93269(NCT03486067)和用于治疗表达TYRP1的黑色素瘤的TYRP1-TCB(RG6232)。
此外,岸迈生物开发的FIT-Ig技术也使用了类似的逻辑,该方法依靠Fab交叉来实现正确的轻链关联,以产生对称的四价N末端融合双特异性抗体(2+2 CrossMabFab格式)。到目前为止,三种不同的双特异性FIT Ig已在临床1期,包括:1)EGFR/c-Met用于受体酪氨酸激酶抑制(EMB-01)(NCT03797391),2)PD-1/LAG-3用于双检查点抑制(EMB-02)(NCT04618393),以及3)BCMA/CD3ε用于多发性骨髓瘤(EMB-06)(NCT04735575)。
CrossMab在其它疾病领域中的应用
在过去几年中,使用CrossMab技术产生了多种针对HIV-1的高效双特异性抗体,用于预防和治疗HIV-1。在这些CrossMab的双抗中,10E8.4/iMab对各种HIV-1菌株表现出极好的效力和广度,目前10E8.4/iMab正在进行一期临床试验评估(NCT03875209)。最近,还报道了第一种基于crossMab的针对SARS-CoV-2的双特异性抗体,靶向SARS-CoV-2受体结合域上的两个非重叠位点并阻断与血管紧张素转换酶2(ACE2)的结合。
在自身免疫性疾病,靶向TNFα/IL-17的1+1和2+2模式的crossMab在体外阻断细胞因子和趋化因子反应方面表现出优越的功效。此外,双特异性抗体对两种细胞因子的联合抑制优于单独对任一细胞因子的抑制。基于这些数据,中和促炎细胞因子的双靶向双特异性抗体可能为自身免疫性疾病提供新的治疗选择。
靶向VEGF/Ang-2的vanucizumab(RG7221)是第一个进入临床试验的抗血管生成双特异性抗体,VEGF和Ang-2在湿性年龄相关性黄斑变性(wAMD)和糖尿病性黄斑水肿(DME)等疾病的眼部血管生成中也起着重要作用。
Faricimab(RG7716)是一种异二聚体1+1模式靶向 VEGF/Ang-2的CrossMab。与vanucizumab相比,Faricimab针对眼内使用和眼科适应症中的高浓度配方进行了特别优化,通过在含有KiH的IgG1 Fc部分中引入P329GLALA和3A突变,消除FcγR介导的效应器功能,并在低全身暴露时回收FcRn。最近,在wAMD和DME患者中进行的四项独立的关键性3期试验报告了积极的结果,并达到了主要终点(NCT03823287、NCT03823300、NCT03622580、NCT03622593)。根据这些数据,Faricimab已提交FDA审查。
此外,在中枢神经系统(CNS)疾病,BS-GANT(RG6102)通过靶向转铁蛋白受体和淀粉样蛋白β,使之通过血脑屏障,显示出改善大脑暴露和防止斑块形成。BS-GANT最近进入了前驱或轻中度阿尔茨海默病患者的2期临床试验(NCT04639050)。
小结
在过去的20年中,已经开发了许多技术来产生双特异性抗体,CrossMab技术代表了一种简单、直接且经临床验证的抗体工程解决方案,使用现有的抗体对,通过最小工程实现正确的轻链关联。事实上,它已经与KiH技术一起发展成为工业界和学术界最成熟、最通用、应用最广泛的技术之一。
基于制备双特异性和多特异性抗体的进展,相信crossMab技术会在各种疾病的治疗产生重大影响,包括肿瘤、传染病、自身免疫、中枢神经系统和代谢性疾病,为患者带来福音。
参考文献:
1.Ten years in the making: application of CrossMab technology for the development of therapeutic bispecific antibodies and antibody fusion proteins. MAbs. Jan-Dec 2021;13(1):1967714.
原文标题 : 详解CrossMab技术