前言
抗体偶联药物(ADC)是由靶向特异性抗原的单克隆抗体与小分子细胞毒性药物通过连接子链接而成,兼具传统小分子化疗的强大杀伤效应及抗体药物的肿瘤靶向性。ADC由三个主要部分组成:负责选择性识别癌细胞表面抗原的抗体,负责杀死癌细胞的药物有效载荷,以及连接抗体和有效载荷的连接子。
ADC目前已成为治疗血液恶性肿瘤和实体瘤的一类热门药物,进行了广泛的临床前和临床研究。然而,与大多数细胞毒性药物的情况一样,由于耐药机制的出现,ADC作为单一疗法产生的客观反应或临床益处的持续时间仍然受到限制。因此,ADC与其他抗癌药物的组合成为ADC药物开发的一个重要方向。
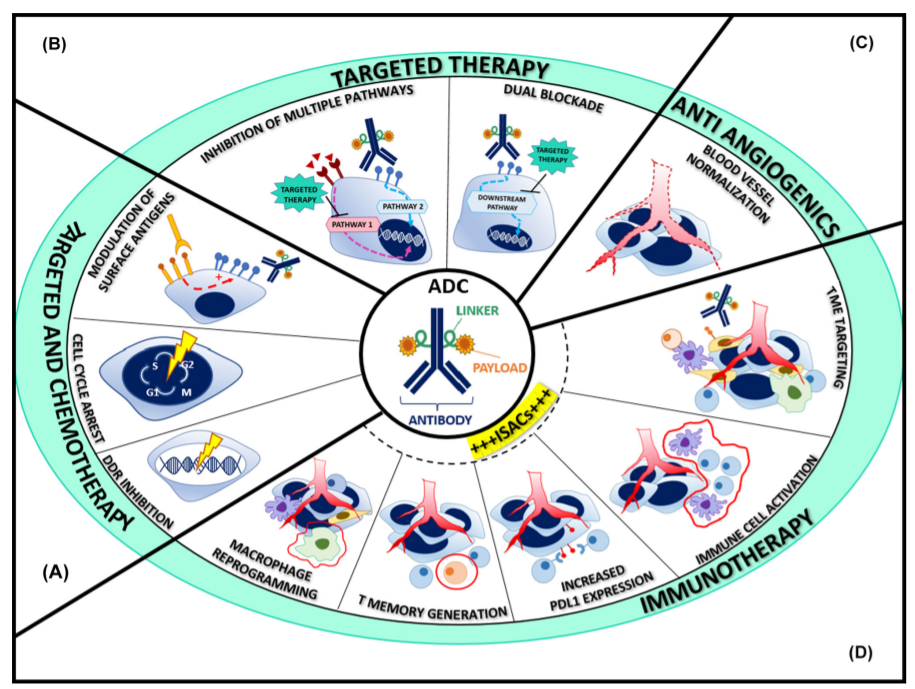
目前,监管部门已批准了针对血液肿瘤的ADC与化疗/化学免疫治疗的组合,FDA也授予了enfortumabvedotin和pembrolizumab的突破性疗法认定。与ADCs组合最有吸引力的药物是那些对肿瘤细胞或其微环境具有加成或协同作用而没有不可接受的重叠毒性的合作伙伴。包括抗血管生成药物、HER2靶向药物、DNA损伤应答剂和免疫检查点抑制剂(ICIs)的联合用药是目前积极研究的方向。
ADC联合化疗
ADC与化疗药物的最佳组合需要更好地理解独特的细胞周期相互作用以及细胞毒性伴侣对表面抗原表达的调节。到目前为止,越来越多的临床前和临床数据显示出良好的应用前景,并为指导进一步的药物开发提供了宝贵的见解。
细胞周期相互作用
作用于S期并产生G2/M期阻滞的DNA损伤剂(例如抗代谢药物、铂和拓扑异构酶抑制剂)可与微管抑制剂组合。卡铂与mirvetuximabsoravtansine、anetumab ravtanine或luveltamab tazevibulin在卵巢癌模型中的成功组合,说明了这一概念。在早期临床试验中,以ravtansine为基础的ADCs与卡铂或阿霉素联合治疗对铂敏感和耐药的卵巢癌患者,以及以deruxtecan为基础的ADCs与卡培他滨或顺铂联合治疗胃癌和肺癌患者的疗效显著。
给药时间的设计
给药时间可能与药物组合设计相关。微管蛋白聚合是ADC内吞机制的关键组成部分,DNA损伤介导的G2/M期阻滞可能需要一些时间让微管破坏物敏化发生。在结肠癌、肺癌和乳腺癌模型中的研究很好地证明了这一点,连续给药SGN-15(Lewis Y抗原- doxorubicin)和紫杉醇比同时给药引起更多的DNA碎片。这一观察表明,调整给药时间,特别是抗微管药物之后延迟给与DNA损伤剂,可能会提高治疗效果。
表面抗原的调节
化疗药物可以调节ADC靶向的表面抗原的表达。在这方面,吉西他滨已被证明可以上调胰腺腺癌细胞中HER2的表达,其中吉西他宾和trastuzumab emtansine的组合发挥了增强的效力。与上述细胞周期相互作用交织在一起,HER2上调尤其发生在G2/M群体中,这是吉西他滨介导的DNA合成抑制的结果。
重叠毒性
ADC本质上是化疗,因此联合方案的疗效提高往往会受到不可接受毒性的阻碍。主要毒性由细胞毒性有效载荷代谢产物驱动,在设计组合策略时必须仔细考虑。这些毒性包括MMAE和DM1衍生物引起的周围神经病变、MMAF和DM4引起的眼毒性、DM1或拓扑异构酶抑制剂的胃肠道效应、或calicheamicin衍生物引起的肝毒性,以及几乎普遍的中性粒细胞减少症和血小板减少症。
两项2a/b期研究证明了这一点,这两项研究调查了trastuzumab emtansine与多西紫杉醇或紫杉醇联合治疗HER2+晚期乳腺癌症,其中一半以上的患者需要减少剂量或停止紫杉烷。新的、更具肿瘤选择性的ADC药物,如mirvetuximab soravtansine和datotomab deruxtecan显示出更温和的毒性,使其成为具有不同作用机制的化疗药物的理想伴侣。
ADC联合靶向药物
与标准化疗相比,ADC的治疗指数有所提高,对选择性肿瘤群体的活性也有所提高,这使其成为靶向药物的理想合作伙伴。人们可以设想各种组合策略,以克服治疗耐药性和克隆异质性,引发对癌基因依赖性信号通路的更强抑制,增加表面抗原的可用性并使低抗原表达肿瘤敏感,调节肿瘤微环境。
用ADC替代化疗
到目前为止,许多研究试图用ADC替代标准化疗,作为靶向药物的组合,但结果令人失望。KAITLIN、KRISTINE和MARIANNE等临床试验是基于与trastuzumab emtansine联合pertuzumab的协同抗肿瘤活性而设计的,然而在新辅助和转移环境中,与紫杉醇、曲妥珠珠单抗和帕妥珠珠单抗相比,其并没有显示出增强的疗效。同样,在卵巢癌中,联合贝伐单抗,anetumab ravtansine的疗效低于紫杉醇。
酪氨酸激酶抑制剂(TKIs)
通过添加TKI的双靶点阻断可以提供更大的选择性,并可能改善治疗指数。在TEAL研究中,与标准的紫杉醇、trastuzumab和pertuzumab联合用药相比,trastuzumab emtansine、泛-HER2抑制剂lapatinib和白蛋白结合性紫杉醇联合用药在HER2+乳腺癌患者的新辅助治疗中的反应有所改善Trastuzumabemtansine和tucatinib(一种更具选择性的抗HER2TKI)的组合,在既往紫杉烷和trastuzumab治疗后进展的晚期患者中实现了47%的客观应答率(ORR),包括脑转移患者中36%的脑特异性应答率。新一代ADC和TKI可能会获得更好的结果。
靶向ADC耐药
越来越多的证据支持靶向药物可以同时靶向已知的ADC耐药机制。例如,由于HER2对乳腺上皮细胞的恶性转化依赖于细胞周期蛋白D1,CDK4/6抑制剂已在HER2耐药患者中与trastuzumab emtansine联合使用。此外,另一种关键的细胞周期调节因子PLK1最近被确定为获得性和原发性trastuzumab emtansine耐药模型中的上调靶点,其抑制剂volasertib可使trastuzumab emtansine在体外和体内再增敏。另一方面,ADC也可能是调节靶向药物耐药机制的有效组合。例如,osimertinib和trastuzumab emtansine的联合用药产生了额外的抗肿瘤作用,其中trastuzumab emtansine能够延迟或克服EGFR突变非小细胞肺癌模型中osimertinib的耐药性。
表面抗原的调节
一些TKI已被证明可调节表面抗原,可能促进进一步的ADC活性,并使低抗原表达肿瘤敏感。在这方面,lapatinib, neratinib,tucatinib, 和poziotinib已被证明可提高trastuzumabemtansine的疗效。然而,具体的机制原理仍不明确。其中lapatinib通过强烈的转录上调和减少泛素化增加HER2丰度,neratinib通过刺激内化和内吞作用降低表面HER2丰度,tucatinib对细胞表面HER2的影响仍然难以捉摸,而poziotinib上调外显子20突变,但不上调野生型HER2,这表明协同机制与表面HER2密度无关。
抗血管生成
抗血管生成剂可促进ADC穿透和肿瘤细胞暴露。anetumab ravtansine或mirvetuximab soravansine与贝伐单抗在卵巢癌症临床前模型中的联合应用具有完全响应的有效性。最近的一项1b期研究将mirvetuximab soravtansine和贝伐单抗联合用于重度预处理、铂耐药、FRα高的卵巢癌症患者,其中39%的ORR超过了关键AURELIA试验的基准值(27%)。
DNA损伤反应剂
通过将靶向DNA损伤反应(DDR)的药物与携带DNA损伤剂的ADC相结合来开发合成致死,可能是治疗基因组不稳定肿瘤的一种有前途的策略。
传统上,DDR药物与化疗的结合受到无法耐受毒性的阻碍,而携带拓扑异构酶I抑制剂有效载荷的新一代ADC的优越活性和耐受性使其更适合作为搭档。多个临床试验正在探索这一策略,包括niraparib和trastuzumab duocarmazine、talazoparib和sacituzumab govitecan,以及olaparib和trastuzumab deruxtecan。除了PARP抑制外,ADC对化疗的选择性增加无疑将扩大可组合DDR药物的范围,例如,ATR抑制剂berzosertib联合sacituzumab govitecan的临床实验目前正在进行中(NCT04826341)。
ADC联合免疫疗法
免疫疗法和ADC的组合策略最近已进入临床实验。尽管临床前数据和早期临床研究的结果表明抗肿瘤活性增强,但支持该方法优于标准治疗的随机临床试验结果仍在等待中。
抗PD-1/PD-L1和抗CTLA-4抗体
越来越多的证据表明,ADC可能会提高免疫治疗剂的疗效。所涉及的机制是多种多样的,以及增强免疫记忆和免疫调节蛋白(如PD-L1和MHC)的表达。一些ADC在具有完整免疫系统的临床前模型中表现出更大的效力,支持其免疫调节功能的相关性。
多种HER2靶向ADC,包括trastuzumab emtansine, trastuzumab deruxtecan和disitamab vedotin,已在体外和体内与ICI联合测试,证实了与增强的归巢和免疫效应物激活相关的协同活性。KATE2研究是唯一一项公开发表的检测ADC加ICI的随机试验,该研究比较了预治疗HER2+乳腺癌患者中trastuzumab emtansine联合atezolizumab对比trastuzumab emtansine联合安慰剂的疗效。联合治疗未能改善无进展生存期(8.2 vs 6.2个月,P=0.33),表明在HER2靶向治疗同时添加ICI可能仅对PD-L1阳性人群有益。尽管在这项随机试验中观察到令人失望的结果,但在多种肿瘤中临床探索仍在进行。
此外,越来越多的临床前证据表明,组合疗法可能会恢复免疫敏感性。例如,在ICI难治性黑色素瘤和非小细胞肺癌(NSCLC)患者模型中,AXL特异性ADCenapotamab vedotin与抗PD-1抗体联合进行了测试,其中ADC通过诱导T细胞浸润和增强抗原提呈,增强了ICI活性并导致TME中的促炎性变化。
ADC联合其他免疫疗法
Polatuzumab vedotin已被证明通过增加AKT和ERK信号增强肿瘤细胞上CD20的表达,支持其与抗CD20抗体(例如利妥昔单抗)和CD20/CD3双特异性抗体疗法的联合。此外,ADC和免疫调节剂的组合也正在其他疾病中探索,如多发性骨髓瘤。在临床前模型中,belantamabmafodotin与OX40激动剂的组合产生了协同抗肿瘤活性,增加了肿瘤内T细胞和树突状细胞的浸润和活化。临床上正在积极研究belantamabmafodotin的组合方案,如DREAMM-5研究(NCT04126200),该研究与多种免疫治疗剂包括(抗ICOS抗体、OX40激动剂以及γ-分泌酶抑制剂)以及抗PD-1抗体联合给药。初步结果表明,联合抗ICOS抗体在重度预处理患者中具有良好的活性。
此外,ADC的设计不仅可以针对癌症细胞,还可以调节TME的元素,如免疫细胞或成纤维细胞,从而改变免疫反应性。例如,靶向CD73的ADC显示出令人鼓舞的临床前活性。此外,在临床前模型中与pembrolizumab联合使用时,靶向癌相关成纤维细胞的ADC显示出增强CD8+T细胞介导的抗肿瘤活性。
小结
作为单药的ADC已证明具有抗肿瘤功效,并在多种实体瘤和血液瘤中获得了批准。学术界和工业界目前正在进行广泛的努力,通过确定新的靶点和增强其药理作用来开发下一代ADC,以及基于目前ADC的联合疗法。
然而迄今为止,使用第一代和第二代ADC的组合方法成功有限,这可能归因于几个因素,例如靶点的非特异性表达导致正常组织中的不良反应、重叠毒性、不同肿瘤克隆中的疗效不足以及新出现的抗药性机制。因此,需要深刻了解ADC的药理学以及相关的预测性生物标记物组合,在特征良好的患者衍生异种移植模型中进行临床前评估,从而选择最有前途的基于ADC的组合。相信未来基于ADC的联合疗法将展现出光明的前景。
参考文献:
1.Antibody-drugconjugates: in search of partners of choice. Trends Cancer.2023 Feb 4
原文标题 : ADC联合治疗的研究进展







