声明:本文为火石创造原创文章,欢迎个人转发分享,网站、公众号等转载需经授权
摘要
2022年11月,全球批准新药数量有所回升。FDA批准7款新药(NDA/BLA),包含0款新获批的新分子实体药物(NDA:Type 1 - New Molecular Entity),3款生物制品药物(BLA),其中ELAHERE是一款首创的(first-in-class)抗体偶联药物,华东医药于2020年10月授权引进,拥有其大中华区的独家临床开发、商业化权益;EMA新授权8款药品上市,其中2款新活性物质(NAS);NMPA批准4个品规(3个品种)创新药上市,均属化药,分别为璎黎药业的林普利塞片、绿叶制药的盐酸托鲁地文拉法辛缓释片和红日药业的甲苯磺酰胺注射液。
医疗器械方面,FDA有3个通过上市前批准(PMA)途径首次上市的产品。境内没有公示三类医疗器械进入创新审批绿色通道,批准了2个创新器械上市,境内医疗器械审批集中在体外诊断试剂,共631项,占31.74%。
01
全球药品获批情况
(一)美国FDA批准情况
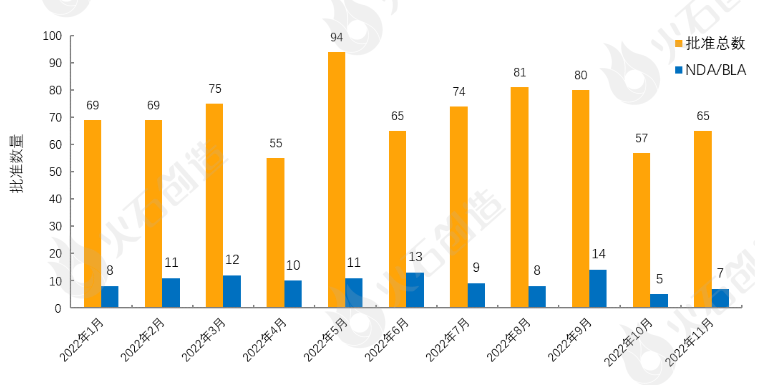
图1 2022年1—11月FDA药物批准数量变化情况
来源:美国食品药品监督管理局
如图1,截至2022年12月7日FDA官网披露,2022年11月FDA共完成65项药品首次批准(不包含暂时批准),其中NDA/BLA批准7款(不包含暂时批准),见表1。其中包括0款新获批的新分子实体药物(NDA:Type 1 - New Molecular Entity),3款生物制品药物(BLA)。
ELAHERE是一种靶向叶酸受体α(FRα)的首创(first-in-class)抗体偶联药物(ADC),也是FDA批准的第一种用于治疗铂耐药疾病的ADC,2020年10月20日,杭州中美华东制药有限公司与IMMUNOGEN INC达成授权引进合作,华东医药将全面负责该药在大中华区的临床开发、注册和商业化;SEZABY(注射用苯巴比妥钠粉)是美国第一个也是唯一一个专门用于治疗足月儿和早产儿的新生儿癫痫发作的产品,此次批准将为新生儿癫痫提供有效的治疗选择;TZIELD是第一种可预防/延缓特定人群发展为临床1型糖尿病(3期T1D)的疗法,这是继一个世纪前胰岛素问世以来,1型糖尿病治疗方面取得的第一个重大进展。
表1 2022年11月FDA批准NDA/BLA药物列表

来源:美国食品药品监督管理局
(二)欧盟EMA批准情况
截至2022年12月7日EMA官网披露,2022年1月至11月的推荐上市药品及新活性物质(NAS)数量情况见图2,2022年11月EMA未推荐药品上市。

图2 2022年1—11月EMA推荐上市药品数量变化情况
来源:火石创造产业数据中心
截至2022年12月7日,EMA在11月新授权8款药品上市,其中包括2款新活性物质,见表2。
Livtencity是一款新活性物质,用于已接受造血干细胞移植(HSCT)或实体器官移植(SOT)的成人患者,治疗移植后巨细胞病毒(CMV)感染和/或疾病,是欧盟批准用于上述适应症的第一种也是唯一一种疗法,同时,Livtencity是第一种也是唯一一种靶向和抑制CMV特异性pUL97蛋白激酶及其天然底物的口服抗病毒疗法;Pyrukynd用于治疗成人患者的丙酮酸激酶(PK)缺乏症,是一款首创的(first-in-class)口服PK激活剂,也是在欧盟首次获批用于治疗这种罕见的、使人衰弱的终生溶血性贫血患者的疾病修饰疗法;Enjaymo是第一个也是唯一一个被批准用于治疗冷凝集素病(CAD)的药物,其活性成分sutimlimab是一种首创的(first-in-class)人源化单克隆抗体。
表2 2022年11月EMA授权药物列表

来源:火石创造产业数据中心
(三)NMPA批准情况
截至2022年12月7日NMPA披露,2022年11月共批准国产首次注册药品98件。按剂型去重后,共70个药品品种(不同厂家生产同一药物按同一品种计算)。本月有4个品规(3个品种)1类创新药获批,均为化药。2022年11月NMPA批准的1类创新药情况见表3。
表3 NMPA批准的1类创新药获批列表

来源:国家药品监督管理总局
盐酸托鲁地文拉法辛缓释片是山东绿叶制药有限公司主研发并拥有自主知识产权的创新药,适用于抑郁症的治疗。盐酸托鲁地文拉法辛的抗抑郁作用可能与通过抑制5-羟色胺(5-HT)、去甲肾上腺素(NE)的再摄取而增强中枢神经系统的5-HT、NE效应有关。该药品的上市为抑郁症患者提供了更多的治疗选择。
林普利塞片是上海璎黎药业有限公司自主研发并拥有自主知识产权的创新药,可抑制PI3Kδ蛋白的表达,降低AKT蛋白磷酸化水平,从而诱导细胞凋亡以及抑制恶性B细胞和原发肿瘤细胞的增殖。该药品11月8日通过附条件批准、优先审评获批上市,为经现有治疗手段治疗后复发难治的滤泡淋巴瘤成人患者提供了治疗选择。
红日药业的甲苯磺酰胺注射液由中国工程院院士、著名医学专家钟南山挂帅研发,是治疗实体瘤的创新型化学药物,对肿瘤细胞具有高度选择性,是我国首次批准的经纤维支气管镜肿瘤内局部注射的化学消融药物,也是首个适应症为减轻中央型非小细胞肺癌成人患者的重度气道阻塞的药物,填补了呼吸介入药物治疗的空白。
(四)仿制药一致性评价情况
截至2022年12月7日CDE官网披露,CDE共承办药品一致性评价受理号4367个,2022年11月共新增承办72个受理号。截至2022年12月7日,共4991个品规上市药品通过一致性评价(包含视同通过2115个品规),本月共59个品规的药品通过一致性评价(包含视同通过5个品规),按剂型去重后,共43个药品品种。
目前一致性评价品种通过的注射剂共 1837个品规(286个品种),本月过评药品中共计33个品规(20个品种)的注射剂。2022年1月至11月通过一致性评价数量见图3。

图3 2022年1—11月仿制药一致性评价批准数量变化情况
来源:国家药品监督管理总局
02
全球医疗器械获批情况
(一)美国FDA批准情况
截至2022年12月7日,11月FDA共批准275个510(k)途径的产品,其中一类器械22个,二类器械248个,未分类5个。
通过对510(k)上市前通知的器械根据美国医学专业用途进行分类,结果发现,11月产品获批类型最多的为一般和整形手术器械、骨科器械、放射科器械、一般医院和个人使用类器械与牙科器械,见图4。

图4 2022年11月通过FDA 510(k)途径获批上市产品类型分布情况
来源:美国食品药品监督管理局
2022年11月有3个通过上市前批准(PMA)途径首次上市的产品。
表4 2022年11月PMA首次批准的器械

来源:美国食品药品监督管理局
(二)境内批准情况
截至2022年12月7日,2022年11月国家局没有公示三类医疗器械进入创新审批绿色通道。
截至2022年12月7日,2022年11月国家局公示了2个三类创新器械获批上市,见表5。
表5 2022年11月获批上市的三类创新器械

来源:国家医疗器械审评中心
截至2022年12月7日,2022年11月国家局共批准首次注册三类医疗器械产品209个,其中国产177个,进口32个。各省级药品监管部门11月共批准国产第二类医疗器械注册1070个,一类备案医疗器械642个。
统计数据显示,体外诊断试剂数量最多,共631项,占31.74%,基本上均为国产,为618项。除体外诊断试剂,批准注册类别数量排前三位的分别为注输、护理和防护器械,临床检验器械和口腔科器械。
表6 2022年11月国产、进口医疗器械批准注册类别数目分布情况

来源:国家医疗器械审评中心
从地域分布上,2022年11月国产二、三类注册产品批件最多的依次为广东省(223件)、江苏省(220件)、湖南省(168件)三个区域,见图5。

图5 国产获批器械区域分布
来源:火石创造产业数据中心
—END—
作者 | 火石创造 吴雯雯 审核 | 火石创造 刘辉兴 殷莉
原文标题 : 药械月报 | 全球新药批准数量回升,境内器械审批集中在体外诊断试剂










