儿科用药是指适合儿童特殊体质及需求设计的一类药品,尤其指专门在医院儿科使用的药品。儿童药品对于药品剂量、安全性、口味等都有特殊的需求,如通常使用剂量更小、利用矫味剂来改善药品入口的苦味等。儿科用药在我国起步较晚,国内儿童用药生产企业不足,生产的品种和适宜的剂型也比较缺乏。
儿童用药品种少,使用小剂量成人药成普遍现象
我国儿童用药的缺乏导致儿童使用成人药现象普遍存在,而这种现象是由于儿童用药的特点,其所需研发经费高昂、药物评价(临床试验)难度大、市场布局需要长期努力才会产生市场黏性;我国大多数的药品生产企业不愿意研究和生产儿童用药。
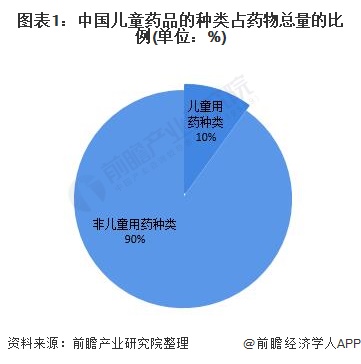
目前,作为药品消费的特殊群体,我国儿童药品的种类占药物总量的比例却不足10%,国内90%以上的儿童用药为非儿童专用药;适宜儿童的剂型、规格也非常缺乏,尤其是低龄儿童、新生儿用药普遍“成人化”。
我国的儿童用药市场发展任重而道,目前我国儿童药物市场仍处于专用品种少、适宜剂型少、生产企业少、企业关注度高但实际研发热度低的局面。由于儿童专用药匮乏,很多患儿在服药时都被当成“缩小版的成人”对待,按照“小儿酌减”的原则把成人药给孩子减量使用。这种做法存在着巨大的安全隐患。
国家食品药品监管总局每年发布的《国家药品不良反应监测年度报告(2019年)》显示,我国14岁以下儿童患者中不良反应报告占10.6%。儿童作为特殊用药人群,因脏器发育尚未完全,对药物更为敏感,耐受性较差,因此,儿童要用“儿童药”。

出台激励政策及修订药品说明书,双管齐下解决儿童用药的发展痛点
近年来,为了解决儿童用药缺乏的痛点,国家对于儿童用药的研发都是鼓励的,鼓励生产企业积极研发仿制药的儿童专用规格和剂型;鼓励立题依据充分且具有临床试验数据支持的儿童专用规格和剂型的申请优先审评。
在2016年CFDA药品审评中心发布了《关于临床急需儿童用药申请优先审评审批品种评定基本原则及首批优先审评品种的公告》,确定了评定的基本原则。此后截止到2020年底,国家已发布3批(包含对不同剂型药品的重复计数)鼓励研发申报儿童药品。

在儿童用药优先审评的政策激励下,在2016年政策发布后,我国儿童用药的优先审评的注册申请数量整体呈现上升趋势。2016-2018年,我国儿童用药的优先审评的注册申请数量逐年上升,2017年的增长率76.47%。然而2019年儿童用药的优先审评的注册申请数量下降,儿童用药的研发热情有所下降。
在2019年,我国相继出台两项儿童用药研发的激励政策,为儿童用药开设了绿色通道;这也从另外一个角度说明了儿童用药研发的难度大,周期性长的痛点。

为了促进我国儿童用药的发展,除了出台激励政策以外,严格打击市面上的成人用药儿童化也是必须的手段,国家首先从规范药品说明书修订开始。与欧盟等发达国家相比,由于儿科用药在我国起步较晚,所以我国许多药品说明书上没有儿童剂量,儿童使用很大部分是通过成人的剂量折算出来的,儿科用药的安全性隐患较大。
为了解决药品说明书这一问题,近年来国家药品监督管理局(NMPA)陆续发布了一些药品说明书的修订公告,增加了儿童用药的相关内容,这也从另一个侧面看出国家也在逐步加强对儿童用药的规范管理。



更多数据请参考前瞻产业研究院发布的《中国儿科用药行业市场前瞻与投资战略规划分析报告》,同时前瞻产业研究院提供产业大数据、产业规划、产业申报、产业园区规划、产业招商引资、IPO募投可研等解决方案。
来源:前瞻产业研究院












暂无评论