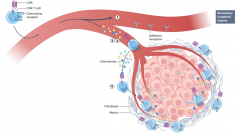
自此,JNJ-4528的研究进展也开始层层推进。在获得FDA授予的孤儿药资格,以及欧盟EMA授予的PRIME药品认定后,2019年12月,杨森公司宣布,美国FDA授予该公司靶向B细胞抗原(BCMA)的CAR-T疗法JNJ-4528突破性疗法认定,用于治疗经治多发性骨髓瘤患者。突破性疗法认定将加快这一创新疗法的开发和审评过程。
目前,全球正在注册开展的CAR-T临床试验主要在中美两国,大多处于临床前期和临床1-2期。据市场调研机构Coherent Market Insights此前统计,2018年至2028年,全球CAR-T细胞免疫治疗市场的平均年复合增长率将达46.1%,其中北美和欧洲依旧是两大主要市场。
不过,在当下的CAR-T制药发展领域上,仍有不少需要应对的风险。除了临床上普遍会产生的细胞因子风暴,还有一个发展瓶颈便是细胞产品的制备CMC。在制备CMC上,就连BMS也未能做到令人满意。在2020年的ASCO会前,BMS原本要着重“宣传”的产品便因数据问题而被FDA拒批。
目前,JNJ-4528的Ⅱ期验证性试验仍于中国进行中。除了JNJ-4528,传奇生物在细胞治疗领域也布局了多条管线,针对非霍奇金淋巴瘤NHL、急性髓细胞性白血病AML、以及治疗NHL的靶点为CD20同种异体CAR-T候选药物等。
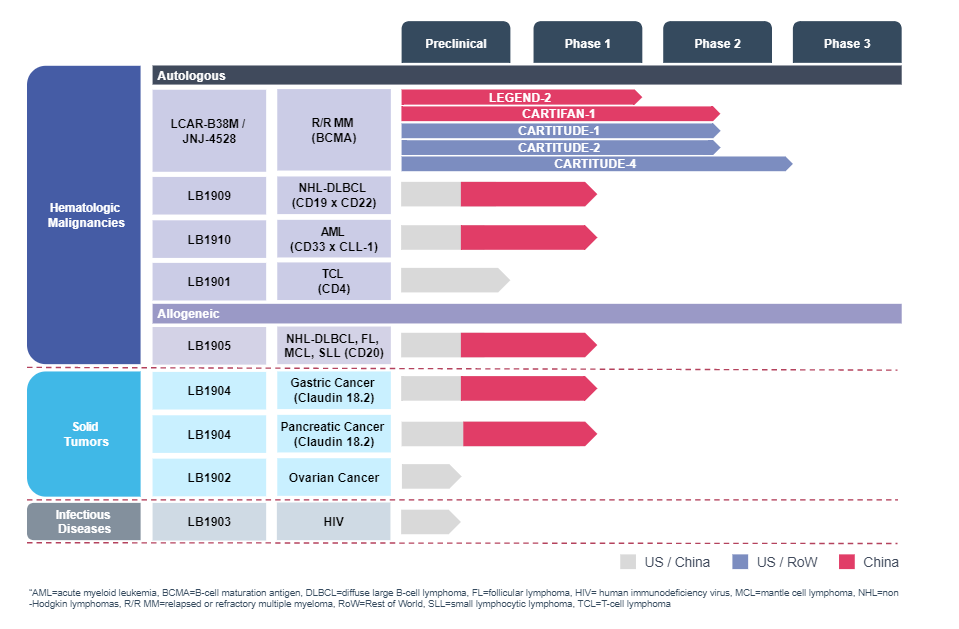
传奇生物研发管线。图源:传奇生物官网
这些管线均为处于临床早期的自体候选组合,其中进展最快的产品仍是JNJ-4528。传奇生物预计于2020年下半年向FDA提交JNJ-4528适用于R/RMM治疗的BLA(生物制品许可申请),并准备推动其在欧洲、中国、日本获批上市。
由于还未有产品上市,传奇生物的收入主要来自与杨森的合约收益。2019年年报显示,报告期内,传奇生物实现营收5726.4万美元,同比增长16.5%,收入包括确认根据协议收到的预付款和里程碑付款。截至目前,杨森向传奇生物支付了3.5亿美元的预付费用和总计1.1亿美元的里程碑付款。