国家药监局官网显示,罗氏的阿替利珠单抗(商品名Tecentriq)已于今日正式在国内获批上市,用于治疗小细胞肺癌。这也是继阿斯利康Durvalumab之后,国内第2款获批上市的PD-L1抗体。
Tecentriq是一款靶向于PD-L1的人源化单克隆抗体,2016年5月18日获得美国FDA批准用于膀胱癌二线治疗,随后又于同年10月被FDA批准用于治疗转移性非小细胞肺癌患者(NSCLC)。
2018年3月,Tecentriq获批小细胞肺癌(SCLC)和三阴性乳腺癌(TNBC)的一线治疗,这也是PD-1/PD-L1类药物首次获批这两类肿瘤的一线治疗。此外,Tecentriq还在同年12月获批与白蛋白紫杉醇联合,用于非鳞非小细胞肺癌(NSCLC)的一线治疗。得益于新适应症的获批,Tecentriq在2019年销售额增长了143%,达到18.75亿瑞士法郎。
2019年2月,罗氏向国家药品监督管理局递交Tecentriq的上市申请,受理号为JXSS1900004。历时一年,Tecentriq成功突围,在中国获批第一个适应症。
罗氏制药中国总裁周虹表示:不到一年的时间,Tecentriq就在中国获批,再一次见证了中国政府加快新药审评审批,让中国患者能够与欧美同步用上最新药物的决心和成绩。小细胞肺癌是Tecentriq在中国获批的第一个适应症,期待未来Tecentriq更多的适应症在中国获批,满足中国肿瘤患者的未尽之需,助力健康中国2030的实现。
肺癌是中国发病率与死亡率最高的癌种。中国医学科学院肿瘤医院肺癌中心主任赫捷教授曾指出,近年来我国肺癌发病率呈现快速增长的趋势。肺癌居男性癌症死因的第一位,女性的第二位,成为中国第一大癌症。
而根据病理类型划分,肺癌可以分为非小细胞肺癌和小细胞肺癌,其中小细胞肺癌约占肺癌的15%,是一种侵袭性强,增殖迅速的恶性肿瘤。
全球科学家一直在针对小细胞肺癌进行各种创新药物研究。自1970年以来,全球有40项针对小细胞肺癌的三期临床试验,但绝大部分试验都以失败告终。
吉林省肿瘤医院党委书记、中国临床肿瘤学会(CSCO)副理事长、CSCO小细胞肺癌专业委员会主任委员程颖教授表示,Tecentriq的获批意味着中国小细胞肺癌进入了一个崭新的时代,小细胞肺癌进入了免疫新时代。
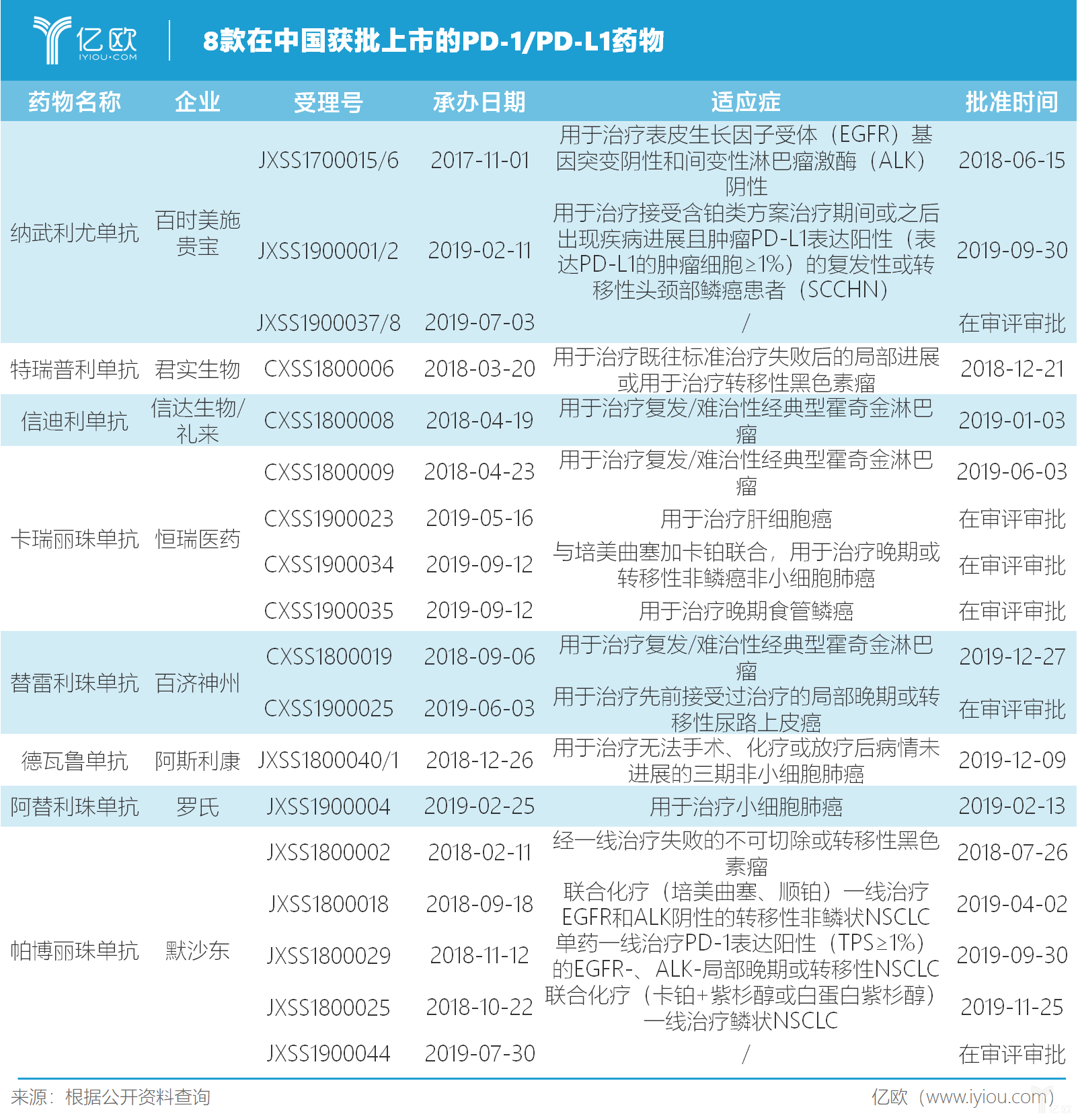
目前,加罗氏制药的Tecentriq在内,国内已有8款PD-1/PD-L1药物在中国获批上市。其中,阿斯利康的Imfinzi于2019年12月9日在中国获批上市,用于治疗同步放化疗后未进展的不可切除III期非小细胞肺癌。