01
文章背景简介
BACKGROUND INTRODUCTION
微生物来源的耐热脂肪酶常常在大肠杆菌中大量过表达,但是,这些酶通常以低酶活性存在,并且主要以包涵体的形式存在。一些研究指出,将其N末端与信号肽融合、使重组蛋白进行分泌表达,可有效解决这个问题。一般来说,这种方法的可行性在很大程度上取决于信号肽的分泌途径和要分泌的目标蛋白的类型。
中国农业科学院Weiqing Zhang等人在2018年在《Microbial Cell FactoriesMicrobial Cell Factories》(IF=4.402,工程技术二区)上发表了题为“Development an effective system to expression recombinant protein in E. coli via comparison and optimization of signal peptides: Expression of Pseudomonas fluorescens BJ-10 thermostable lipase as case study”的文章。该研究对荧光假单胞菌BJ-10高效分泌耐热脂肪酶lipBJ10的信号肽进行了比较和优化。同时,将该方法与细胞质分泌法在分泌可溶性和活性脂肪酶方面进行了比较研究。本文报道的结果可为其他脂肪酶的高水平表达提供参考。
02
所用到的主要方法
METHODS
1.双星胆碱酸法蛋白定量(BCA)
2.实时定量分析
3.形态计量分析
03
文章主要内容摘要
ABSTRACT
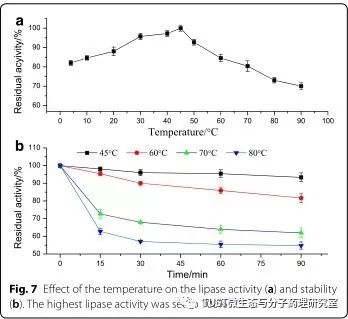
脂肪酶(三酰甘油酯水解酶,E.C.3.1.1.3)可以催化长链三酰甘油的水解,在水介质中释放长链脂肪酸和甘油。因绝大多数脂肪酶热稳定性差,野生型菌株产生的脂肪酶产量低,故而嗜热和耐热微生物脂肪酶目前需求量很大。本文依据前期获得的脂肪酶进行实验,但该脂肪酶的可溶性较差,所以构建了6株携带不同融合表达质粒的菌株,通过比较这6株菌株的性能,确定了最佳的信号序列,筛选出了最优的蛋白信号肽(DsbA)以增强其可溶性蛋白表达。
研究表明使用6个信号肽,即PelB和5个天然大肠杆菌信号肽作为融合伴侣进行融合表达,可以比非融合表达产生更多的可溶性和功能性重组lipBJ10。重组lipBJ10与这六种不同的信号肽融合后,可在大肠杆菌中分泌到细胞周质中。所有融合表达的总脂肪酶活性均高于非融合表达。当lipBJ10与DsbA融合时,相对活性达到峰值,产生的蛋白活性是非融合蛋白的73.3倍。当使用DsbA作为融合伙伴时,活性最高(265.41 U/ml),包涵体的形成最少;其它4个大肠杆菌信号肽在一定程度上会导致活性低且不溶于包涵体。因此,DsbA是与lipBJ10融合的最佳信号肽伴侣,可以有效地生产可溶性和功能性蛋白。与未进行融合的蛋白lipBJ10相比,融合有这些信号肽,特别是DsbA的信号肽,可以显著减少包涵体的形成,增强lipBJ10的功能和溶解性。
▼
相关链接
▼
一种新型无标记、多拷贝毕赤酵母过表达载体的构建与应用













