华中科技大学同济医学院实验部分报告:《今幸胶囊对小鼠 H22 肝癌的免疫调控作用》
1 材料与方法
1.1 样品
今幸胶囊由浙江亚克药业有限公司提供(样品批号:170601),内容物为类白色颗粒,感官检查未见异常。
1.2 实验动物
C57BL/6J 雄性小鼠,6 周龄,由北京维通利华实验动物技术有限公司,饲养于华中科技大学同济医学院无特定病原体(SPF)级实验动物中心,适应性喂养一周后用于实验。
1.3 细胞
小鼠肝癌细胞系 H22 购自 ATCC 细胞库。
1.4 主要药品、试剂
胸腺五肽(thymopentin,TP-5)、顺铂(cis-platinum,CDDP)、RPMI-1640 培养基、胎牛血清、双抗(青霉素、链霉素)、脂多糖(Lipopolysaccharide,LPS)、刀 豆 球 蛋 白 A ( Concanavalin A , ConA ) 、 噻 唑 兰 ( Methyl thiazolyl tetrazolium, MTT)、APC 标记抗小鼠 CD11b 抗体、PE 标记抗小鼠 Gr-1 抗体、PE-Cy5 标记抗小鼠 CD3 抗体、PE 标记抗小鼠 NK1.1 抗体、PE 标记抗小鼠程序性死亡分子(Programmed death-1,PD-1)抗体、FITC 标记抗小鼠 CD4 抗体、PE 标记抗小鼠 CD8 抗体、PE 标记抗小鼠 CD25 抗体、PE 标记抗小鼠 F4/80 抗体、PE-Cy5 标记抗小鼠Foxp3 抗体、FITC 标记抗小鼠 CD11c 抗体、PE 标记抗小鼠 MHCII 抗体、APC 标记抗小鼠CD86 抗体、PE 标记抗小鼠 TCR-β抗体、PE 标记抗小鼠程序性死亡分子 1 配体(Programmed death-1 ligands,PD-L1)抗体、rmGM-CSF、rmIL-4、4%多聚甲醛、Mouse IL-6、IL-10、IL-12、IFN-γ、TNF-α ELISA 试剂盒。
1.5 主要仪器
超净工作台、CO2 培养箱、荧光倒置显微镜、高速冷冻离心机、超纯水机、电子天平、流式细胞仪、恒温振荡器、压力蒸汽灭菌锅、4℃、-20℃、-80℃冰箱、低速离心机、多功能酶标仪、电热鼓风干燥箱。
1.6 实验方法
1.6.1 细胞复苏和培养
H22 细胞,昆明鼠腹水传代。
1.6.2 小鼠 H22 肝癌皮下移植瘤模型的建立
小鼠肝癌 H22 细胞株,于昆明小鼠(KM 小鼠)腹腔内传代保存。腹腔种植小鼠肝癌 H22 细胞后的第七天(已形成腹水),将 KM 小鼠颈椎脱臼处死,75% 酒精浸泡 5min,无菌条件下用 1ml 注射器 4 号针头抽取腹水置于 5ml EP 管中。细胞计数,确定肝癌 H22 细胞个数,调整肝癌 H22 细胞浓度为 107 个/ml 生理盐水(或 PBS)。用 1ml 一次性注射器分别接种至 6 周龄雄性 C57BL/6J 小鼠右前肢腋皮下,每只小鼠注射 0.2ml 细胞悬液(含细胞 5*105 个)。接种后,小鼠每天正常进食,每天观察一次,建立小鼠 H22 肝癌皮下移植瘤模型。
1.6.3 试验分组和给药方法(空白组 10 只,其他组每组 15 只) 空白对照(K)组:正常鼠每天灌胃生理盐水 0.2ml/只。
Model(M)组:荷瘤鼠每天灌胃生理盐水 0.2ml/只。
顺铂(CDDP)组:荷瘤鼠隔天腹腔注射 CDDP 4.8mg/kg,连续注射三周。
今幸胶囊(Jinxing)组:荷瘤鼠每天灌胃 今幸 10mg/kg(前期预实验筛选出的最佳剂量,该剂量以人参皂苷 Rh2 计。),连续给药三周。
CDDP+胸腺五肽(TP-5)组:荷瘤鼠每天腹腔注射 TP-5 0.01mg/kg,隔天腹腔注射 CDDP 4.8 mg/kg,连续三周。
CDDP+Jinxing 组:荷瘤鼠每天灌胃今幸 10mg/kg,隔天腹腔注射 CDDP 4.8mg/kg,连续三周。
CDDP(1w)+ TP-5(2w)组:荷瘤鼠隔天腹腔注射 CDDP 4.8 mg/kg,给药一周,之后每天腹腔注射 TP-5 0.01mg/kg,连续两周。
CDDP(1w)+今幸(2w)组:荷瘤鼠隔天腹腔注射 CDDP 4.8 mg/kg,给药一周, 之后每天灌胃 Jinxing 10mg/kg,连续两周。
每天称量小鼠体重,测量瘤体积,观察小鼠活动及毛皮颜色等。末次给药后, 小鼠经眼眶取血后,颈椎脱臼处死,取胸腺、淋巴结、脾脏、肝脏、内脏脂肪称重。分离脾脏、胸腺和淋巴结淋巴细胞以及骨髓来源的 DCs 测定相关指标。
1.6.4 脾、胸腺、淋巴结细胞悬液制备
无菌条件下迅速取出脾脏,取部分脾组织制备脾淋巴细胞。将脾脏组织放入约含 5ml 无菌 PBS 的培养皿内,清洗三次,用胶头滴管研磨脾脏,经 100 目尼龙筛网过滤,收集细胞悬液于离心管中。1200r·min-1 离心五分钟,加入红细胞裂解液 1ml,1700r·min-1 离心五分钟,再用无菌 PBS 洗涤细胞三遍,用 RPMI-1640 培养基重悬细胞。于倒置显微镜下细胞计数,细胞活力测定需>90%,并调整细胞浓度为 2*107 个/ml。(胸腺、淋巴结细胞悬液制备方法相同)
1.6.5 脾 T、B 淋巴细胞增殖
取上述脾细胞悬液适量稀释为 3*106 个/ml,0.1ml 接种于 96 孔板,每份样品设 3 个复孔,另加 100μL ConA(5μg/mL)或 100μL LPS(10μg/ml)分别刺激 T、B 淋巴细胞增殖,同时设置相应对照孔。37℃ 5%CO2 培养箱中培养 24h 后,每孔加入 20μL MTT(5μg/mL),轻轻振摇后继续培养 4h。取出培养板 3000r·min-1 离心15min,弃掉上清,每孔加入 150μL DMSO 充分溶解甲瓒,于 490nm 和 570nm处用酶标仪检测 OD 值。
1.6.6 脾脏自然杀伤细胞(Natural killer cell,NK)、巨噬细胞、T 细胞受体(T cell receptor,TCR)、髓来源的抑制性细胞(Bone marrow-derived suppressor cells,MDSC)比例及 PD-1 测定
取 100μL 1*107 个/ml PBS 重悬的脾淋巴细胞悬液,NK 细胞加入 PE-Cy5 标记的小鼠 CD3 抗体和 PE 标记的小鼠 NK1.1 抗体;巨噬细胞加入 APC 标记的小鼠 CD11b 抗体和 PE 标记的小鼠 F4/80 抗体;TCR 加入 PE-Cy5 标记的小鼠CD3 抗体和 PE 标记的小鼠 TCR-β抗体;MDSC 加入 APC 标记的小鼠 CD11b 抗体和 PE 标记的小鼠 Gr-1 抗体;PD-1 加入 PE-Cy5 标记的小鼠 CD3 抗体和 PE 标记的小鼠PD-1 抗体,4℃避光孵育 1h,加入 1ml PBS,1200r·min-1 离心 5min, 重复一次,用 300μL PBS 重悬,上流式细胞仪检测细胞百分率。
1.6.7 CD4+CD8+T 细胞测定
研磨脾脏、胸腺和淋巴结,分别制成 1*107 个/ml 的细胞悬液备用,用 PBS
重悬。取 100μL 1*107 个/ml 脾脏、胸腺细胞悬液,均加入 PE-Cy5 标记的小鼠
CD3 抗体、FITC 标记的小鼠 CD4 抗体、PE 标记的小鼠 CD8 抗体,4℃避光孵育 1h,加入 1ml PBS,1200r·min-1 离心 5min,重复一次,用 300μL PBS 重悬, 上流式细胞仪检测细胞百分率。
1.6.8 CD4+CD25+Foxp3+调节性 T 细胞(Regulatory T cells,Treg)测定
取上述浓度为1*107个/ml的脾脏、胸腺细胞悬液100μL,按说明书加入FITC 标记的小鼠CD4抗体和PE标记的小鼠CD25抗体,混匀,4℃避光孵育1h。用flow cytometry staining buffer洗涤细胞两次, 1200r·min-1 离心5min。每个样本加入
fixation/permeabilization工作液800μL,4°C避光反应1h。用permeabilization buffer 洗涤细胞两次,每次1ml,1700r·min-1离心5min。100μl permeabilization buffer重悬细胞,加入PE-Cy5标记的小鼠Foxp3抗体,4°C避光反应1h。用permeabilization buffer洗涤细胞两次,每次1ml,1700r·min-1离心5min。300μL permeabilization buffer重悬细胞,上流式细胞仪检测。
1.6.9 树突状细胞(Dendritic cells,DCs)的分离和培养
取每只小鼠的胫骨和股骨,洗净并分离骨髓,100 目尼龙网过滤去除杂质, 用无菌 PBS 清洗后得到骨髓细胞悬液;加入 1ml 红细胞裂解液,避光反应 2min, 加 3ml PBS 终止,再用 3ml PBS 清洗一遍,计数板计数,用 RPMI-1640 培养基调整细胞浓度约为 2*106 个/ml。取 2ml 细胞悬液加入 6 孔培养板中,再加入rmGM-CSF(20ng/ml)和 rmIL-4(10ng/ml)细胞因子后在 37℃,5%CO2 培养箱中培养。每两天半换液,并在倒置显微镜下观察细胞形态、生长情况及集落的数量和大小。第七天收集细胞待用。
1.6.10 DCs 表面分子测定
取 100μL 1*107 个/ml 的 DCs 悬液(PBS 悬浮),加入指定量的流式抗体:
FITC 标记的小鼠 CD11c 抗体、PE 标记的小鼠 MHCII 抗体、APC 标记的小鼠CD86 抗体、PE 标记的小鼠 PD-L1 抗体。4℃避光孵育 1h,PBS 洗涤 1 次,1200r·min-1 离心 5min,重复一次,用 300μL P BS 重悬,上流式细胞仪检测。
1.6.11 ELISA 测血清细胞因子
在酶标板上分别设空白孔和待测样品孔。待测样品孔中加样品稀释液 25μL, 然后再加待测血清 25μL,样品最终稀释度为 2.5 倍。用封板膜封板后置 37℃孵育 30min。揭掉封板膜,弃去液体,甩干,每孔加满洗涤液,静置 30 秒弃去, 重复5 次。每孔加酶标试剂50μl,空白孔除外。用封板膜封板后置37℃温育30min,洗板 5 次。每孔先加入显色剂 A 50μL,再加入显色剂 B 50μL,轻轻震荡混匀,37℃避光显色 15min。每孔加入终止液 50μL,于 450nm 处用酶标仪检测 OD 值。
2 实验结果
2.1 肿瘤体积
给药组肿瘤体积均小于模型组,且肿瘤体积的增长速度更加缓慢(图 1A), 单一给药组,肿瘤指数均比肿瘤模型(M)组更小,联合给药组肿瘤指数减小更加明显(图 1B),提示 Jinxing 抑癌作用明显,且与化疗药CDDP 联合应用时, 抑癌效果更为显著。
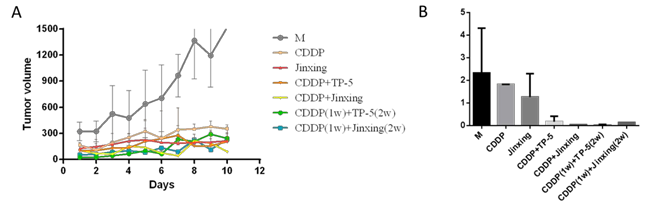
图 1 A 为给药后,各组小鼠肿瘤体积随时间的变化曲线(数值为每隔一天的,天数按顺序增加,下同)。B 为各组小鼠的肿瘤指数。
2.2 小鼠体重,死亡率
CDDP 在发挥抑癌作用的同时,副作用也非常明显。实验中CDDP 组及CDDP与TP-5 和今幸联合给药组(CDDP+TP-5、CDDP+Jinxing、CDDP(1w)+ TP-5(2w)、
CDDP(1w)+今幸(2w)),小鼠状态很差,精神不振,蜷缩少动,从给药开始体重下降明显(图 1A),并且出现不同程度的死亡。其中,CDDP 组死亡率最高,4 组联合给药组死亡率其次,今幸组的死亡率明显低于其他组(图 2B)。今幸组小鼠从给药后体重虽然增长很慢,但并未下降,只是在疾病后期体重才开始逐渐下降。结合上部分结果,提示今幸与 CDDP 联合用药时,能发挥明显的抑癌作用,同时也能明显降低死亡率。
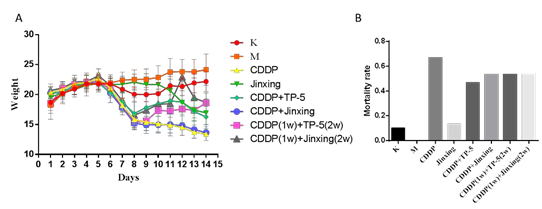
图 2 A 为各组小鼠的体重随时间的变化曲线图。B 为给药后各组小鼠的死亡率。
2.3 血清中细胞因子
IL-10 是一种主要由效应 T 细胞产生的抗炎细胞因子,早期被认为具有免疫抑制作用,近年的研究表明IL-10 也可促进机体免疫反应,可活化 T 细胞和 NK 细胞。M 组IL-10 的含量显著低于K 组,给药后今幸 组、TP-5 组和CDDP(1w)+TP-5(2w)组明显升高(图 3)。提示 今幸可促进血清中 IL-10 分泌。
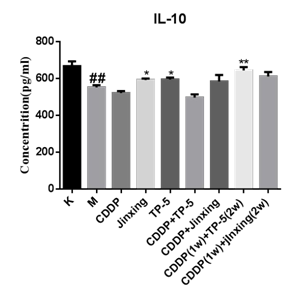
图 3 为血清中 IL-10 的水平。(#表示与空白组比较,*表示与模型组比较; *P≤0.05,**P≤0.01,***P ≤0.001,#P 同*P。(下同)
2.4 CD4+T 细胞、CD8+T 细胞
模型组与空白对照组相比,脾脏和胸腺中的 CD4+T 细胞 CD8+T 细胞比例都下降,给药后出现不同程度地上升:
CD4+T 细胞(脾脏)(图 4A):今幸 组高于CDDP 组,CDDP(1w)+今幸(2w)组高于 CDDP(1w)+TP-5(2w)组;
CD4+T 细胞(胸腺)(图 4C):今幸组高于 CDDP 组;
CD8+T 细胞(脾脏)(图 4B):今幸 组高于 CDDP 组,CDDP+今幸 组高于 CDDP+TP-5 组,CDDP(1w)+今幸(2w)组高于 CDDP(1w)+TP-5(2w)组;
CD8+T 细胞(胸腺)(图 4D):今幸组高于 CDDP 组。
结果提示单用一种药物时,今幸能通过上调脾脏中 CD4+T 细胞和 CD8+T 细胞的比例,发挥免疫增强作用。联合用药时,先用化疗药,再用 Jinxing 效果更好,且对 CD4+T 细胞和 CD8+T 细胞的刺激能力强于 CDDP(1w)+TP-5(2w)。(实验中也检测了胸腺中联合用药组的CD4+T 细胞和 CD8+T 细胞比例,但效果不明显,图略。)
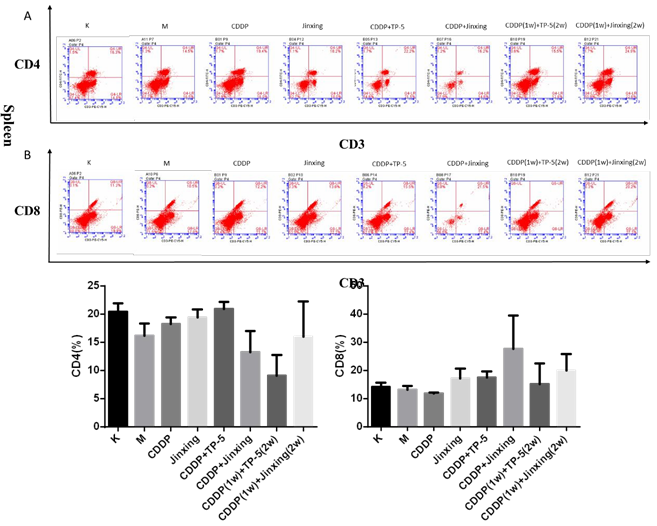
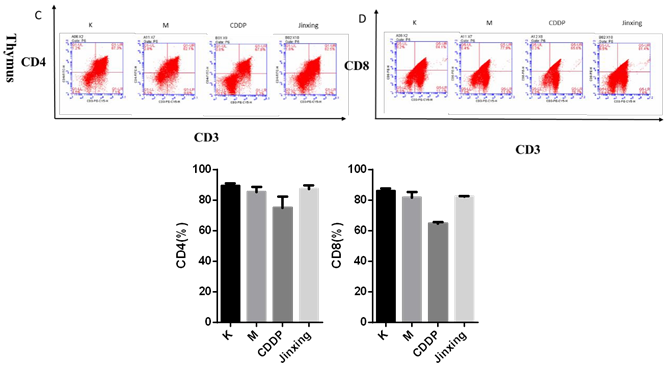
图 4 脾脏、胸腺中 CD4+T 细胞和 CD8+T 细胞比例。A 为脾脏中 CD4+T 细胞的比例。
B 为脾脏中 CD8+T 细胞的比例。C 为胸腺中 CD4+T 细胞的比例。D 为胸腺中 CD8+T 细胞的比例。
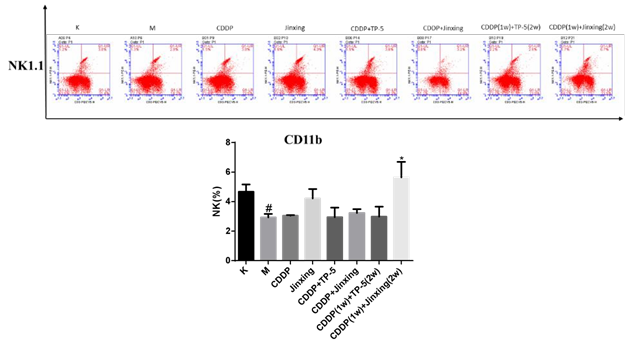
2.5 脾脏中 NK 细胞
模型组 NK 细胞比例低于正常组,给药后比例均上升。今幸 组高于 CDDP 组,CDDP(1w)+今幸(2w)组高于 CDDP(1w)+TP-5(2w)组,CDDP+今幸 组高于 CDDP+TP-5 组。结果提示,单用 今幸 或先用 CDDP 再用 今幸 都能促进NK 细胞增殖,增强免疫,今幸 与化疗药 CDDP 同时使用效果不明显。
2.6 脾脏中免疫抑制细胞
MDSC(图 6A):模型组 MDSC 比例高于空白对照组,给药后除 CDDP 组和 CDDP+TP-5 组外,其他组均下降。CDDP+J今幸 组下降程度最大,其次为今幸 组、CDDP(1w)+今幸(2w)组。提示 今幸单用或与 CDDP 联合用药都能下调脾脏中的 MDSC,发挥免疫增强作用。
Tregs(图 6B):与空白组相比,模型组、CDDP 组和 今幸 组 Treg 比例稍低于空白对照组。提示单用 今幸 能下调 Treg,发挥免疫增强作用。
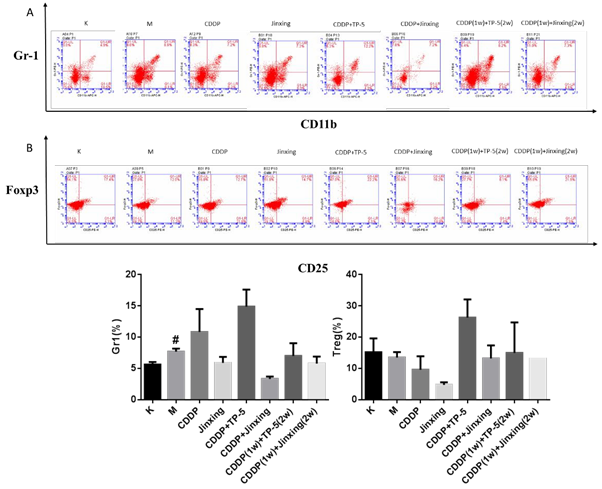
图 6 脾脏中 MDSC 和 Treg 的比例。A 为脾脏中 MDSC 的比例。B 为脾脏中 Treg 的比例。
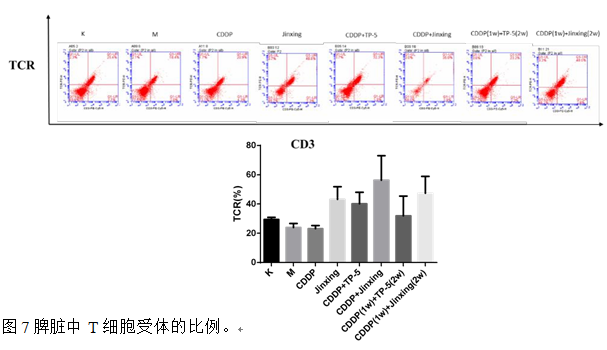
2.7 脾脏中 TCR
脾脏中模型组 TCR 比例低于空白对照组,给药后除 CDDP 组,TCR 比例都上 调 。今幸 组 高 于 CDDP 组 , CDDP(1w)+Jinxing(2w) 组 高 于CDDP(1w)+TP-5(2w)组,CDDP+今幸 组高于 CDDP+TP-5 组,说明 Jinxing 对脾脏中的 TCR 有明显的上调作用,且与 CDDP 联合用药时效果强于 TP-5。
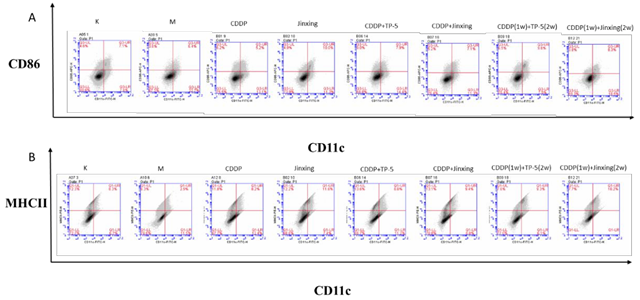
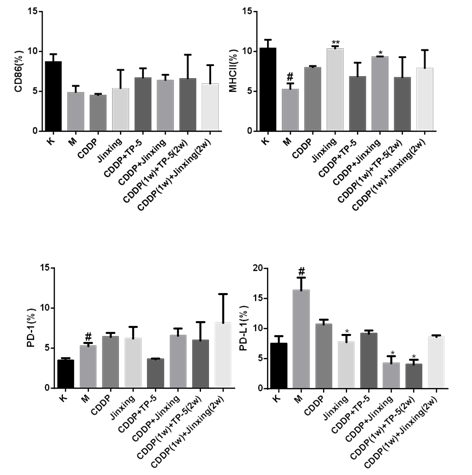
2.8 骨髓来源的 DCs共刺激分子 CD86(图 8A):模型组比例下降,给药后除 CDDP 组外都上调 , 今幸高 于 CDDP 组 , CDDP+TP-5 组 高 于 CDDP+Jinxing 组 , CDDP(1w)+TP-5(2w)组高于 CDDP(1w)+今幸(2w)组,说明 Jinxing 能上调 DC 表面的 CD86 分子,且单用时上调效果更明显。
DCs 表型 MHCII(图 8B):模型组 MHCII 比例低于空白对照组,给药后比例均上调。今幸 组高于 CDDP 组,CDDP+今幸 组高于 CDDP+TP-5 组,CDDP(1w)+今幸(2w)组高于 CDDP(1w)+TP-5(2w)组,提示 今幸 对 MHCII分子有明显的上调作用,且联合用药时效果强于 TP-5。
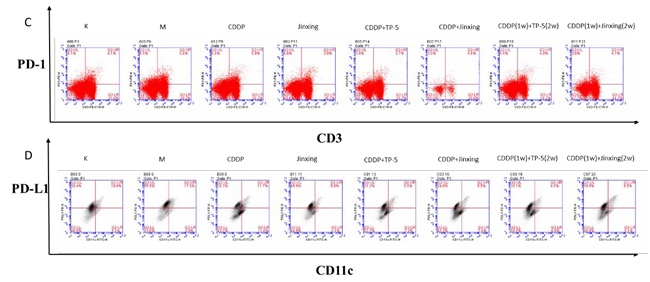
脾脏中 PD-1/DCs 表面 PD-L1(图 8C、8D):模型组脾脏表面的 PD-1 分子比例高于空白组,Jinxing 组低于 CDDP 组,CDDP+Jinxing 组高于 CDDP+TP-5 组,CDDP(1w)+今幸(2w)组高于 CDDP(1w)+TP-5(2w)组。模型组 DCs 表面的PD-L1 分子表达较空白组高,今幸 组低于 CDDP 组,CDDP+今幸 组低于CDDP+TP-5 组, CDDP(1w)+今幸(2w) 组高于 CDDP(1w)+TP-5(2w) 组, 由于PD-1 与 PD-L1 结合发挥免疫抑制作用,因此结果提示今幸 单用能同时下调脾脏表面的 PD-1 分子和 DCs 表面的 PD-L1 分子,发挥免疫增强的作用。
3 实验结论
图 8 DCs 的表面分子比例。A 为 DCs 表面共刺激分子 CD86。B 为 DCs 表型 MHCII。C 为脾脏表面 PD1 分子。D 为 DCs 表面 PD-L1 分子。
研究结果表明:
1、今幸胶囊与化疗药 CDDP 联合用药具有明显的抑癌作用。
2、今幸胶囊没有明显副作用,在治疗过程中基本能稳定小鼠的体重,使小鼠保持较好的生理状态。而化疗药 CDDP 虽然抑癌明显,但副作用很大,小鼠体重下降明显,死亡率很高,今幸胶囊与 CDDP 联合用药后能降低小鼠死亡率。
3、今幸胶囊能增加脾脏、胸腺中的 CD4+T 细胞和 CD8+T 细胞,NK 细胞和 TCR, 降低脾脏中 MDSC 和 Treg 细胞,促进 DCs 表面 CD86 和 MHCII 分子表达,促进 DCs 的成熟,降低 PD-1 与 PD-L1,发挥免疫增强作用。与 CDDP 联合用药时, 今幸胶囊与免疫增强剂 TP-5 相比,今幸胶囊对脾脏中 CD4+T 细胞和 CD8+T 细胞、TCR 的上调作用,对DCs 表面的 MHCII 分子的上调作用,均强于 TP-5 与CDDP 联合用药。今幸胶囊还可促进血清中 IL-10 的分泌,间接调节免疫功能。
4、实验中采用今幸胶囊的剂量以人参皂苷 Rh2 计为 10mg/kg,根据今幸胶囊中人参皂苷 Rh2 含量以及人和小鼠给药剂量换算,该剂量与产品说明书上日服用量基本一致。