-01-
引言:当抗体遇上寡核苷酸,
基因治疗的“高精度快递”
在抗体偶联药物(ADC)成功撬动千亿肿瘤市场后,新一代抗体-寡核苷酸偶联药物(AOCs)正在冲破传统疗法的天花板。这种通过单克隆抗体精准递送基因治疗载荷(如siRNA、反义RNA)的技术,被视为“靶向+基因编辑”的终极组合。然而,从实验室到临床的征途上,AOCs的技术难点与商业化挑战远超想象。
-02-
AOC是谁?
重新定义靶向基因治疗的底层逻辑
1. 从ADC到AOC:革命性递送平台的升级
AOCs由单克隆抗体与寡核苷酸(ONs)通过化学连接子或生物偶联技术结合而成,核心技术逻辑是“抗体导航+基因调控”。与ADC递送小分子毒素不同,AOCs的核心价值在于将基因药物(如siRNA)精准输送到靶细胞,通过调控致病基因表达实现治疗。例如:Avidity Biosciences的AOC 1001是全球首款进入临床的AOC,靶向转铁蛋白受体1(TfR1),递送siRNA治疗1型肌强直性营养不良(DM1),通过沉默异常RNA毒性实现病理逆转。
2. 技术差异化:为什么AOCs是下一个十年的必争之地?
与传统基因治疗载体(如病毒或脂质纳米颗粒)相比,AOCs具有双重优势:
精准靶向:抗体介导的内吞作用可突破难以穿透的生理屏障(如血脑屏障、肌肉组织);长效持久:单抗的长半衰期大幅延长基因药物的作用时间,减少给药频率。 Dyne Therapeutics的FORCE™平台为例,其设计的AOCs针对肌肉细胞表面受体,通过系统性给药实现肌肉组织特异性积累,临床前研究显示单次给药可维持基因沉默效果超过3个月。
-03-
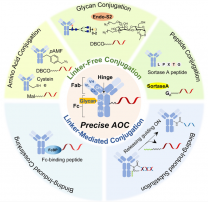
AOC的四大“技术命门”:偶联工艺的精密博弈
1. 连接子技术:稳定与释放的终极平衡
连接子需同时满足“循环中稳定”+“胞内高效释放”两个矛盾需求。目前主流的偶联策略包括:
化学交联法:如硫醇-马来酰亚胺偶联,可实现快速反应,但易发生随机偶联(如Avidity早期工艺);
无连接子法:如基于微生物转谷氨酰胺酶(mTG)的定点偶联(案例:Thiomab技术),可在抗体特定位点(如Fab区)引入非天然氨基酸,实现DAR(药物抗体比)精准控制。
2. DAR控制:不均一性是疗效与毒性的“不定时炸弹”
案例显示,DAR>4的AOCs易因电荷过载导致抗体聚集,显著影响药代动力学。目前通过位点特异性偶联(如Cysteine-Engineered抗体)可将DAR控制在2~4之间,但同时带来工艺复杂性指数级上升。
3. 寡核苷酸修饰:如何在“递送屏障”中杀出血路?
未经修饰的siRNA易被血清核酸酶降解。已获批siRNA药物(如Alnylam的Onpattro)采用2'-O-甲基化+硫代磷酸骨架双重修饰以提高稳定性,但引入过多修饰可能削弱基因沉默效率。AOCs的设计需在化学修饰与功能活性间找到最佳平衡点。
4. 脱靶效应:抗体与寡核苷酸的双重风险
AOC的脱靶风险既来自抗体的非特异性结合(如TfR1在肝、脑均有表达),也源于寡核苷酸的序列依赖性副作用。例如,Allergan 开发的针对 VEGF 受体的 siRNA 药物AGN-745(Sirna-027)在 II 期试验中由于脱靶效应而停止使用。
-04-
CMC与工业化生产——从毫克级到千克级的“死亡谷”1. CMC三座大山:纯度、收率、成本
中间体控制:抗体的内源性核酸残留(如中国仓鼠卵巢细胞DNA)可能干扰偶联反应,需增加切向流过滤(TFF)和离子交换层析步骤;终产物纯化:AOC的电荷异质性使得传统Protein A纯化效率不足,行业转向多模式层析(如Capto Core 700树脂)结合疏水相互作用层析(HIC)的多步纯化策略,导致收率降至40%以下(传统抗体收率>70%)。2. 分析技术滞后:难以量化的工艺“黑箱”
现有分析手段(如质谱、毛细管电泳)对DAR>2的AOCs分辨率不足。此外,在进行DMPK研究时,考虑到AOC药物偶联寡核苷酸本身的摩尔量以及寡核苷酸系统循环快速清除的特征,检测游离寡核苷酸通常需要更高灵敏度的分析平台,特别是对于偶联稳定的AOC药物。
-05-
临床与商业化突破:谁在领跑黄金赛道?
1. Clinical Pipeline全景图:肌肉与中枢神经系统成主战场截至2024年,全球进入临床的AOCs超过20款,适应症集中于罕见病与实体瘤:

2. AOC 1001:首个闯关III期的“探路者”
2013年成立至今,Avidity已通过其抗体寡核苷酸偶联物(AOCs TM )平台孵化出多款创新AOC产品。同时,作为领域先驱的Avidity在融资上也异常顺利,备受资本市场青睐,2024年2月29日,最新完成了一轮价值4亿美元的私募融资,累计融资已达10亿美元级别。而AOC 1001是Avidity的主要候选产品,被开发用于治疗强直性肌营养不良1型(DM1),由专有的转铁蛋白受体1(TfR1)抗体与靶向强直性肌营养不良蛋白激酶(DMPK)mRNA的siRNA偶联而成,旨在通过降低DMPK相关mRNA的水平以解决DM1的根本病因,更是历史上第一个进入临床的AOC药物。 2024年3月,AOC 1001的来自MARINA开放标签扩展试验(MARINA-OLE)的最新积极长期数据公布,其在治疗1型强直性肌营养不良(DM1)的患者时,与自然疾病历史数据相比,在多个临床终点逆转疾病进展。基于这些鼓舞人心的成果,AOC 1001的3期临床试验HARBOR已经正式启动,预示着Avidity Biosciences在AOC药物领域的研发工作即将进入一个新的阶段。3. 下一个爆发点:CNS疾病的破局利器Denali Therapeutics是一家专注于神经退行性疾病的生物制药公司,公司开发了专有的转运载体(TV)技术平台,能够使治疗用生物大分子更有效地穿过血脑屏障,包括酶、抗体、蛋白质和寡核苷酸。另外,Denali将TfR1视为通往大脑的门户。排列在血脑屏障中的细胞表达着TfR1,因此,TfR1是寡核苷酸、蛋白质和抗体药物进入中枢神经系统的理想途径。DNL310是一款由人艾杜糖-2-硫酸酯酶(IDS)与Denali的酶转运载体(ETV)结合的ASO药物,DNL310被设计为可以递送IDS蛋白至包含脑部的全身细胞与组织的溶酶体中,以对GAG进行分解,从而达到治疗MPS II的目的。2023年6月,公司公布了DNL310用于MPS II治疗的I/II期临床结果。数据显示,与基线相较,MPS II患者血清中的神经丝蛋白轻链(NfL)水平显著减少达64%。目前DNL310的临床II/III期试验正在全球进行中。4. T-CpG全身给药,实现靶向免疫激活Tallac开发了一种新型Toll样受体(TLR)激动剂抗体偶联物平台(TRAAC)。多功能免疫激活平台通过全身给药提供强效的TLR9激动剂(T-CpG),以实现靶向免疫激活,可以诱导机体产生天然性和适应性免疫反应,达到治疗多种恶性肿瘤的目的。TAC-001是一种全身给药的TRAAC分子,由强效TLR9激动剂与CD22抗体结合而成,旨在选择性地激活B细胞以驱动抗肿瘤免疫反应。2022年7月,Tallac宣布TAC-001针对晚期实体瘤患者的1/2期研究已经完成了首例给药。2023年11月,Tallac首次公布了TAC-001在实体瘤患者中的1期临床安全性和有效性数据。单药TAC-001(0.1至3毫克/千克)耐受性良好,表现出与其提出的MOA一致的药效学活性,并产生了初步的临床活性,患者获得了持久稳定的疾病(≥6个月)和RECIST1.1标准的部分应答。
-06-
结语:AOC的星辰大海与近在眼前的荆棘
AOCs的临床价值毋庸置疑,但其工业化之路仍布满技术深壑。从业者需在三重维度破局:工艺上开发更稳健的定点偶联技术,分析上建立高分辨率质控体系,临床策略上寻求未被满足的适应症(如神经系统疾病)。这场关于“精准递送”的马拉松,谁能在技术深水区率先上岸,谁将定义下一代基因治疗的黄金标准。
原文标题 : 从精准靶向到临床应用,抗体寡核苷酸偶联药物如何突破三大核心瓶颈?