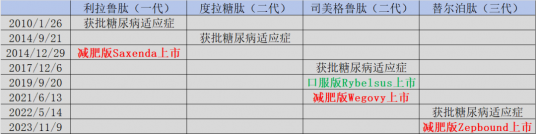
前言
GLP-1R因其优异的降糖、减重功效而爆火,代表性药物司美格鲁肽还通过不断拓展心血管、NASH新适应症持续出圈,预计2024年将荣登药王宝座。GLP-1成为近年来最火热的研发药物之一。然而,GLP-1作为人体内源肽,其本身半衰期短的问题也成为了各家研发企业首要解决的问题。
从氨基酸替换、脂肪链的引入、融合蛋白策略,再到抗体偶联和药物缓控释技术,GLP-1长效策略历经更迭,并正突破周制剂的限制,向更长效制剂发展。
长效GLP-1制剂开发难点
GLP-1(胰高血糖素样肽-1)是一种由肠道内分泌L细胞和脑干孤束核内的某些神经元在进食后产生和分泌的活性肽类激素。在人体内,其通过结合GLP-1受体(GLP-1R),激活受体的信号传导,从而发挥了抑制胰高血糖素分泌、增加胰岛素分泌、减缓胃肠道蠕动、抑制食欲等的生物学功能,从而可以参与人体内血糖平衡调节。此外,GLP-1还有延缓胃排空、抑制食欲、心血管保护的功能。

图1. GLP-1的作用机制
尽管GLP-1有诸多优点,但临床开发最致命弱点是GLP-1在血液中的半衰期较短,主要原因有两个:一是因为被受体内二肽基肽酶4 (DPP-4) 以及中性肽链内切酶(NEP)所降解,两者的切割会使GLP-1失活。二是GLP-1在体内会被肾脏清除而快速降解,这使得内生GLP-1在体内的半衰期约为 2 min,且只有 10-15% 的GLP-1 完整地进入循环,空腹血浆水平仅为 0-15 pmol/L。

图2. GLP-1酶切位点
解决方法无非是“开源节流”,最早期采用的是“节流”的方式,科学家设计了小分子二肽基肽酶抑制剂,并最终成功用于临床,从而降低GLP-1在体内的降解,从而达到降糖作用,但疗效和时效并不好。“开源”是指通过优化GLP-1结构及载体技术提高体内GLP-1(类似物)的浓度和作用时间,以获得更好的治疗效果,提升患者的依从性。
短效GLP-1受体激动剂通过氨基酸取代等方式减少其被蛋白水解降解,如每日两次的艾塞那肽,但这类药物在肾脏中被快速清除,仍难以延长循环时间;因此,一系列修饰递送的策略如白蛋白融合、Fc蛋白融合、脂肪酸酰化等应用,开发出了利西拉肽、利拉鲁肽等日制剂和度拉糖肽、司美格鲁肽、替尔泊肽等周制剂。
虽然已上市产品将治疗频率从每日减少到每周,但从文献报道来看,与每日一次给药频率相比,每周一次给药频率并不能显著提高患者的依从性,仍存在改进的空间。临床数据表明,T2D 患者一年内对注射司美格鲁肽的依从性在 39% 至 67% 之间,使用该药物减肥的患者依从性并不算高。

图3. GLP-1酶切位点

第一代长效策略
第一代的长效策略是氨基酸序列的改造和修饰,艾塞那肽和利西拉肽是第一代长效策略的产物。该长效策略的灵感来自从吉拉毒蜥(Heloderma suspectum)的唾液中发现的Exendin-4,其结构与人类GLP-1仅有53%的同源性,但其和人GLP受体的结合能力要比GLP-1强,这归因于两者N端关键氨基酸的高度相同。
与GLP-1相比,Exendin-4的第二位置的Gly取代了Ala,因此对DPP-4的消化作用更加耐受,使得 Exendin-4能够有30min的半衰期,皮下注射能够保持2.4h的有效浓度。基于Exendin-4的特性,通过对其序列的改造和修饰,得到了两款药物艾塞那肽和利西拉肽两款药物。其中,艾塞那肽每日注射两次,利西拉肽每日注射一次。

图4. 利西拉肽与Exendin-4序列比对
第二代长效策略
第二代长效策略包括了引入脂肪酸链、脂融合白蛋白、融合Fc蛋白等分子设计策略,也包括药物缓释系统这一制剂开发策略,正是这些策略的使用让GLP-1周制剂被成功研发。
1
脂肪酸链的引入
除了抑制DPP-4,Novo Nordisk的科学家们从另一个角度切入,看到了与白蛋白结合对GLP-1类药物的巨大优势,能够有效延长其半衰期。白蛋白(Albumin)是血浆中含量最高的一种蛋白质,可以跟脂肪酸结合,并有重要的生理意义,至今为止,人们已经发现白蛋白上与脂肪酸结合的11个位点。基于此,Novo Nordisk的科学家们开始专注于在GLP-1上引入脂肪酸链。
引入脂肪酸链延长GLP-1半衰期的机制主要有:脂肪酸与质膜和注射部位的白蛋白结合形成复合物,由于尺寸较大,同时脂质化修饰导致多肽药物分子疏水性增加,导致注射后组织中和毛细血管壁上的扩散速率降低;除此之外,进入系统循环的脂化多肽,由于与白蛋白之间的可逆、高亲和结合,提高了多肽药物的药代动力学特征,降低肾脏清除率并利用FcRn介导的循环利用来增加半衰期。

图5. 引入脂肪酸链后与白蛋白的作用机制
总的来说,脂质化的潜在优势主要归因于几个关键作用:提升半衰期、增强递送、提高药理效力和降低免疫原性。

图6. 引入脂肪酸链后GLP-1与白蛋白的作用机制
脂肪酸链的引入效果受到脂质类型、长度和引入位点的影响。脂质类型方面,与引入一元脂肪酸相比,脂肪二酸类型的引入利于提供更强的白蛋白亲和力,由于引入了额外的羧酸基团,因此可能导致更长的半衰期。引入长度方面,在一定范围内,其与白蛋白结合的亲和力随烷基链的长度而增加。1,18-十八烷二酸(C18二酸)和 1,20-二十烷二酸(C20二酸)是迄今为止测试过的对白蛋白具有最高亲和力的脂肪酸,因此具有更长的半衰期。引入位点方面,合适的位点决定了药物的最佳效力和半衰期,尤其是当脂肪酸直接修饰到主链。

图7. C18二酸和C20二酸化学结构
利拉鲁肽、司美格鲁肽是引入脂肪酸以延长半衰期的经典代表。

图8. 利拉鲁肽与司美格鲁肽结构
2
PEG修饰
聚乙二醇(PEG)是由经环氧乙烷聚合而成,其相对分子量(Mr)主要在200-40000的乙二醇高聚物。聚乙二醇中性、无毒、具有独特的理化性质和良好的生物兼容性,并且是少数被FDA批准可用于体内注射用药的化学物质。
长效化是PEG修饰药物对药效的主要改良方向之一。但其应用远不局限于“长效化”,还能改变化合物的理化性质使前药在到达特异性作用靶点后被活化而发挥药效,或改变小分子的脂溶性或水溶性以降低毒副作用等等。
目前全球已有二十余款PEG修饰药物获批上市,市场规模超百亿元。其中PEG重组人生长激素和PEG干扰素、培非格司亭等PEG修饰大分子药物已在国内广泛应用。
将PEG修饰的位点转移至C端(羧基)则是一种有效的修饰策略。PEG洛塞那肽就是一个应用的例子。
2019年5月,NPA通过优先审评审批程序批准豪森药业的 1 类创新药PEG洛塞那肽注射液。该药物是全球第一款PEG化的长效降糖药物,每周仅需注射一次。独特的PEG修饰技术赋予洛塞那肽多项优势,使其半衰期延长,在显著降低血糖的同时,血糖波动小,起效快,且不良反应发生率降低。
Diapin Therapeutics由双鹭药业与美国密歇根大学合作合资设立,最初主要从事开发糖尿病预防/治疗药物,后又增加心脑血管治疗领域的药物开发。目前,双鹭药业持有Diapin Therapeutics 30%的股权。

图9. 聚乙二醇洛塞那肽
3
融合白蛋白
通过融合白蛋白增加药物半衰期是多肽药物设计的常见技术。对于重组蛋白和多肽药物等,可以通过人血清白蛋白(HAS)修饰提高药物半衰期,减少给药频率,提高患者顺应性。

图10. 血清白蛋白(HSA)的应用
白蛋白显著增强GLP-1药物在体内半衰期主要通过两个方式:一方面GLP-1与白蛋白融合后,分子量增大,因此无法穿过肾小球上皮细胞间隙,逃脱了被肾脏清除,继续回到血液循环中发挥药效作用;另一方面,白蛋白还可以和内皮细胞的FcRn结合,通过FcRn内化循环,逃逸溶酶体的降解,再进入循环系统。

图11. 白蛋白延长半衰期机制
早期的HSA修饰是将多肽直接与HSA进行融合,没有引入连接肽。比如GSK开发的Albiglutide于2014-4-15获FDA批准上市,用于Ⅱ型糖尿病的治疗,是第一个获批的HSA融合的长效药物。Albiglutide将GLP-1的8位氨基酸突变为GLY后进行串联,然后直接融合到HSA的N端,其半衰期可延长至5天,每周给药一次即可。然而,2017年,GSK宣布该药物从全球市场撤出。

图12. Albiglutide结构
4
融合Fc蛋白
Fc融合蛋白是一种结合肽或蛋白的试剂,是一种基于IgG的嵌合融合蛋白,其不仅保留了功能蛋白分子的生物学活性,还具有一些抗体的性质,如通过结合相关 Fc 受体延长半衰期。

图13. Fc融合蛋白结构
Fc融合蛋白含有的抗体Fc段,虽不能进行抗原-抗体反应,但Fc段可介导抗体依赖的细胞介导的细胞毒性(antibody-dependent cell-mediated cytotoxicity, ADCC)、补体依赖的细胞毒性(complement dependent cytotoxicity, CDC)作用等各种生物学功能,并且可以根据4种亚型介导的细胞毒差异选择融合伴侣。依靠融合伴侣的长效机制,可通过新生儿Fc受体(neonatal Fc receptor, FcRn)介导的循环途径延长药物在血浆内的半衰期、增加融合蛋白的稳定性等。
利用Fc延长半衰期最成功的案例是礼来的明星药物度拉糖肽,其应用了多个长效策略:首先应用了氨基酸替换策略,将8位的丙氨酸(Ala)替换为甘氨酸(Gly8)以抵抗DPP-4降解,22位的甘氨酸(Gly)替换为谷氨酸(Glu22)从而稳定了分子的二级结构并提高了效力,将36位的精氨酸(Arg)替换为甘氨酸(Gly36),以避免潜在的T细胞表位;其次,选择了IgG4的Fc区域来起到延长半衰期的作用,同时为了减少其与FcR的相互作用,对其中几个序列做了修改,避免ADCC免疫副作用。最后,在GLP-1类似物和Fc部分之间使用一个包含16个氨基酸的超长连接子,避免了因为和Fc融合而带来的药物失活。

图14. 度拉糖肽结构
5
药物缓释系统
利用药物递送系统提高GLP-1药物半衰期的尝试包括:聚合物水凝胶、纳米颗粒和微球等。然而,到目前为止,只有基于聚乳酸-羟基乳酸共聚物(PLGA)的GLP-1药物获得了FDA的批准。
(1)微球制剂
缓释微球制剂可使包裹于其中的多肽类药物缓慢释放,在体内达到缓释长效的作用。以可生物降解聚合物如PLGA 为骨架材料,包裹蛋白多肽类药物制成注射微球,通过肌肉或皮下注射给药,随着聚合物的降解,药物以扩散、溶蚀 方式释放,可缓慢释放 1 周,或长达数月,可大大减少给药次数,显著提高患者用药的顺应性。

图15. PLGA结构式
微球制剂已广泛引应用于多肽领域,代表性药物有亮丙瑞林微球、曲普瑞林微球、奥曲肽微球和帕瑞肽微球等。可以通过人为控制聚合制备工艺,改变黏度及分子量等参数,进而灵活地控制载药微球的降解速度,以调节所包埋多肽药物的释放速率。
注射用艾塞那肽微球,是FDA批准的基于PLGA的艾塞那肽聚合物微球制剂。虽然PLGA的降解时间长达六个月以上,但艾塞那肽-PLGA微球制剂仅仅能实现每周一次的给药频率。

图16. Glutazumab结构
艾塞那肽微球制剂虽然可以实现每周一次给药,但有一个缺点是无法在体内以稳定的速率释放GLP-1 药物。

图17. 注射用艾塞那肽微球药物释放曲线
微球制剂是实现每月一次给药的有效途径。但大多数早期开发的PLGA注射剂都具有突释特征,导致注射后几天体内的药物浓度很高,PLGA微球在体内的突释会导致严重的不良反应。
(2)水凝胶长效制剂
微球制剂虽然增加了多肽药物的效用,但微球仍需要被优化,以实现适当的药库相容性和释放行为,并且只有相对疏水性的多肽才能显示出长达数月的释放。因此,科学家们开始转向利用水凝胶技术,以开发出一年3-4次注射的超长效GLP-1制剂。
基于水凝胶的制剂(Hydrogel-based formulations)是亲水性聚合物在水性介质中形成交联网格的制剂。水凝胶中含水量很高,可以用于亲水性小分子、大分子药物和细胞的递送。为获得长效水凝胶制剂,药物分子必须要先包载到聚合物的网格中,通过高密度交联来降低聚合物链之间的间距,这可以减缓药物从凝胶基质中的扩散速率。水凝胶制剂释放药物的机制主要依靠聚合物的降解和侵蚀作用,可以持续释放药物数周至数月。
近期,由斯坦福大学工程学院科学家、Novo Nordisk研究人员组成的联合团队开发出了一种新型水凝胶药物递送系统(水凝胶储库技术),可以将 GLP-1 的给药频率减少到 4 个月一次。根据他们的计算模型,该递送系统在大鼠体内分泌治疗浓度的利拉鲁肽 42 天,相当于在人类体内分泌 4 个月。
研究团队开发出了一款聚合物纳米颗粒(PNP)水凝胶,将疏水修饰的 HPMC 与 PEG-PLA 纳米颗粒混合制备的 PNP 水凝胶能够以 100%的效率轻松封装GLP -1 受体激动剂。这种水凝胶由聚合物链和纳米颗粒组成的网状物形成的,它们彼此之间的结合较弱,虽然可以像水凝胶一样结合,但随着时间的推移会缓慢消散,网状物包载药物分子,网状物溶解进而释放药物。

图18. 水凝胶制剂结构
由于这种聚合物纳米颗粒水凝胶具有一定的流动性,可以使用常规注射器注射,其注射后会在皮肤下形成一个微型“药物仓库”,注射后能够在体内停留长达 4 个月,持续释放 GLP-1 受体激动剂发挥功效。
在动物模型试验中,研究人员将其注射到 T2D 模型大鼠中,在为期 6 周的监测时间内,这两种药物都保持在治疗浓度,并与标准注射药物一样降低了动物的血糖水平。

图19. 基于新型水凝胶的 GLP-1 药物在人体内的药代动力学建模
每 4 个月一次的治疗可能是临床糖尿病管理的理想选择,因为这将与患者复诊的典型节奏保持一致,而这种水凝胶系统的释放时间可以从一天到六个多月不等,该项技术有望使GLP-1药物注射频率减少至1年3次。围绕此次 GLP-1 受体激动剂的研究,如果接下来的实验,研究人员预计将在一年半到两年内开展人体临床试验。
第三代长效策略
如果说第二代长效策略使每日制剂进化成为每周制剂,那第三代长效策略则有可能使每周注射的GLP-1制剂向每月一次甚至几个月一次的制剂迈进。
1
抗体偶联策略
融合蛋白仍非长效机制的最优解,串联肽-抗体融合物容易受到蛋白水解作用,Regeneron给出抗体偶联GLP-1类似物的新策略。
2022-3-17,Regeneron的GLP-1R靶向ADC新药的专利WO2022056494公开。专利中,Regeneron将特异性靶向GLP-1R胞外结构域的抗体或与功能性激活GLP-1R的GLP-1肽模拟物相偶联,组合成的抗体-药物缀合物。Regeneron给这项技术起了个新的名词:antibody-tethered drug conjugates (ATDCs),抗体束缚药物缀合物。
值得注意的是,Regeneron的这款GLP-1R靶向ADC与传统的ADC有所不同,抗体结合GLP-1R的胞外区,而payload结合的是GLP-1R的跨膜区。这一机制的优势是:促进了亲和力、提升药效的同时,提升了GLP-1多肽的稳定性与半衰期,降低清除率,达到长效稳定的GLP-1激动效果。

图20. Fc融合蛋白结构
相比于GLP-1,这种GLP-1R ATDC具有更强的激动剂活性。在临床前试验中,Regeneron选择了高脂饮食肥胖小鼠模型。度拉糖肽作为阳性对照,给药频次为每周两次,持续4周。而三个ATDC化合物均为只在第0天,单次给药。实验持续8周,每组给药均为25 mpk。
实验结果显示出了这款新药对体重长效控制效果:度拉糖肽组小鼠仅在第3天与第7天观察到了减重效果,之后便体重反弹。而三个ATDC实验组小鼠,尽管只接受了单次给药,减重效果分别维持了4周、6周与8周。这一临床前结果页体现出ATDC药物相较于GLP-1多肽的优势,初步具备成为月制剂的潜力。
2
抗体融合策略
将 GLP-1 融合到一个大的“载体”部分是延长半衰期和给药间隔的有效方法。
2018年,Gmax (鸿运华宁生物)团队在《Biochemical Pharmacology》杂志刊文,报道了Glutazumab 抗体通过双结合位点作用机制在抗糖尿病治疗效果。
研究团队将23个氨基酸的肽连接物GLP-1(7-35)片段与人源化GLP-1R抗体(IgG2)的轻链融合。Glutazumab具有天然GLP-1的药理作用和高特异性抗体的结构属性。研究团队通过实验证实了Glutazumab中的 Ab1 和 GLP-1 片段都有助于 GLP-1R的结合和激活,同时GLP-1R抗体片段 Ab1 可能通过受体靶向减少脱靶效应。

图21. Glutazumab结构
Glutazumab具有与度拉糖肽类似的激动剂性能,并强于野生型GLP-1多肽,由于抗体识别的因素,Glutazumab诱导的胰岛素分泌能力强于度拉糖肽。
鸿运华宁给出的长效策略是串联GLP-1多肽与GLP-1R单抗的融合蛋白,Glutazumab表现出了优于同类GLP-1类似物的安全性、耐受性,以及降糖减重效果,有望成为新一代超长效降糖(2周甚至每月一次)和减重(1周甚至每月一次)治疗药物。
结语
GLP-1药物长效策略经过了三代的发展,每一代药物都是基于上一代药物的长效策略进行优化迭代,凝结了几代科学家的研发智慧。
从氨基酸序列的修饰替换、到引入脂肪酸链,再到微球、水凝胶等长效策略,GLP-1药物已升级到了每周一次制剂;但每周一次给药仍不能很好地提高患者依从性,抗体偶联、抗体融合等策略应运而生,在不久的未来有望诞生一年仅需注射数次的降糖、减肥制剂,这将是GLP-1领域的巨大突破。

图22. GLP-1药效发展进程
| 引用资料
[1] Gradel, A. K. J. et al. Factors affecting the absorption of subcutaneously administered insulin: effect on variability. J. Diabetes Res. 2018, 1205121.
[2] [3] Mosekilde, E. et al. Modeling absorption kinetics of subcutaneous injected soluble insulin. J. Pharmacokinet. Biopharm. 1989, 17, 67–87.
[3] [5] Harris, J. M. et al. Pegylation: a novel process for modifying pharmacokinetics. Clin. Pharmacokinet. 2001, 40, 539–551.
[4] Bak, Mijeong, et al. "Recombinant peptide production platform coupled with site-specific albumin conjugation enables a convenient production of long-acting therapeutic peptide." Pharmaceutics 12.4 (2020): 364.
[5] https://doi.org/10.1016/j.xcrm.2023.101292
[6] https://news.stanford.edu/2023/11/21/drug-delivery-system-reduce-daily-diabetes-shots-just-three-year/
[7] https://www.fiercebiotech.com/research/car-ts-targeting-special-solid-tumor-antigen-work-well-some-mouse-models-challenges-remain
[8] Yu, Minzhi, et al. "Battle of GLP-1 delivery technologies." Advanced drug delivery reviews 130 (2018): 113-130.
[9] Lee, E.S., Youn, Y.S. Albumin-based potential drugs: focus on half-life extension and nanoparticle preparation. Journal of Pharmaceutical Investigation 46, 305–315 (2016).
[10] 猎药人俱乐部:GLP-1RA长效策略:联合融合蛋白/抗体技术,续写“延长GLP-1半衰期”的新篇章
[11] 医麦客:GLP-1类药物的“内卷”指南
[12] 医药魔方:万物皆可偶联:再生元的减肥药GLP-1 ADC
- END -
原文标题 : GLP-1药物长效策略集锦