一项新研究利用阿尔茨海默病患者的诱导多能干细胞来研究阿尔茨海默病的进展,为进一步了解阿尔茨海默病提供了新的窗口。

范安德尔研究所
10月18日消息
由范安德尔研究所(Van Andel Institute,VAI)、隆德大学(Lund University,LU)和佛罗伦萨大学(University of Florence,UniFI)的科学家开发的一个新模型将使研究人员更好地了解阿尔茨海默病在大脑中的进展。
像其他神经退行性疾病一样,阿尔茨海默病的研究具有挑战性。它非常复杂,需要很长一段时间才能发展起来,而且因人而异。关键是,科学家们还缺乏监测人类大脑疾病进展的非侵入性技术。他们经常依赖于模拟疾病的模型,使他们能够追踪阿尔茨海默病的发展和影响大脑的方式。
“为了让模型发挥作用,模型必须密切反映阿尔茨海默病在现实生活中的进展方式。我们的新模型复制了这一过程的许多关键方面,” 范安德尔研究所副教授、描述该模型研究的共同通讯作者 Laurent Roybon 博士说,“这项工作的一个优势是我们使用了阿尔茨海默病患者的细胞系,这有助于我们在模型中更好地反映实际的疾病过程。”

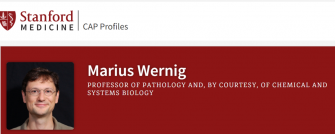
该研究的通讯作者Yuriy Pomeshchik博士(左)和Laurent Roybon博士
这项研究发表在《神经病理学通讯学报》(Acta Neuropathologica Communications)杂志上。隆德大学的 Yuriy Pomeshchik 博士是通讯作者之一。Roybon 在 2022 年加入 VAI 之前,是隆德大学的副教授。

研究于2023年9月15日发表在《Acta Neuropathologica Communications》(最新影响因子:7.1)杂志上
新模型利用了诱导多能干细胞(iPSCs),即被重编程为早期“空白”状态的成体细胞。从那里,科学家可以诱导这些细胞成为其他类型的细胞,如神经元。这种强大的技术可以让科学家研究与他们的祖先拥有相同遗传背景的人类脑细胞。
然而,在大脑微环境之外研究这些细胞提出了另一个挑战。大脑细胞受益于一个严格调控的生态系统,促进细胞的健康和功能。为了解决这个问题,研究小组使用了来自阿尔茨海默病患者的 iPSCs 来生成脑细胞。
然后将这些细胞移植到免疫缺陷野生型小鼠的大脑中,并监测标志性阿尔茨海默病病变的发生情况:蛋白质斑块和缠结、炎症、线粒体功能障碍以及病变在大脑中移动的能力。
研究人员发现,该模型成功地复制了大脑通路的关键变化,这些变化可能随后导致淀粉样斑块的形成,以及邻近细胞中与疾病相关的变化,这表明疾病病理可能正在从一个细胞扩散到另一个细胞。蛋白质组学分析还揭示了伴随疾病从早期进展到晚期的变化。

新模型解决了阿尔茨海默病研究中的一个核心问题:尽管细胞模型和小鼠模型长期以来都有助于阿尔茨海默病的研究,但将两者结合起来更准确地反映了阿尔茨海默病在人类体内的发展和进展。这种模型被称为嵌合模型,结合了两个模型系统的优点。
接下来的步骤,Roybon 说,是监测细胞病理学是如何在较长时间内发展的,并调查病理是如何基于导致阿尔茨海默病的各种基因突变的不同。此外,该团队计划解决他们的新模型的局限性,例如产生更具体地反映大脑特定区域细胞群的 iPSCs。


创立于1321年的意大利佛罗伦萨大学


创立于1666年的瑞典隆德大学


创立于1996年的范安德尔研究所
参考文献
Source:Van Andel Institute
New model leverages stem cells to provide window into Alzheimer's disease development
Reference:
Pomeshchik, Y., Velasquez, E., Gil, J. et al. Proteomic analysis across patient iPSC-based models and human post-mortem hippocampal tissue reveals early cellular dysfunction and progression of Alzheimer’s disease pathogenesis. acta neuropathol commun 11, 150 (2023). https://doi.org/10.1186/s40478-023-01649-z
免责声明
本公众号上的医疗信息仅作为信息资源提供与分享,不用于或依赖于任何诊断或治疗目的。此信息不应替代专业诊断或治疗。在做出任何医疗决定或有关特定医疗状况的指导之前,请咨询你的医生。
原文标题 : 利用干细胞的新模型提供了了解阿尔茨海默病发展的窗口