前言
黑色素瘤是最具侵袭性和致命性的皮肤癌。一些历史观察表明,黑色素瘤是一种免疫反应性肿瘤,通常与紫外线照射和肿瘤突变负荷(TMB)升高有关,这有助于提高免疫原性。黑色素瘤通常具有反应性淋巴细胞浸润,肿瘤周围淋巴细胞的浸润程度与更好的预后相关,基于肿瘤浸润淋巴细胞(TIL)分布的黑色素瘤分类(活跃、非活跃和缺失)至今仍在使用。
自2011年至今,免疫检查点抑制剂ipilimumab被批准用于晚期黑色素瘤已有十年了,其成为第一种延长黑素瘤生存期的治疗方法。其后,在2014年,另一个关键的T细胞免疫检查点PD-1抑制剂pembrolizumab和nivolumab被批准用于治疗转移性黑色素瘤。
尽管免疫检查点阻断(ICB)在黑色素瘤中的临床成功证实了重新激活免疫系统以治疗该疾病的效果,然而,即使在联合ICB的最佳方案中,仍然有大约一半的患者无法实现长期获益。这表明需要更好的反应预测生物标志物和新的合理靶点,以更有效的联合治疗克服免疫抵抗。现在是时候回顾在调节免疫系统治疗癌症方面所吸取的经验教训,以进一步扩大当前和新兴免疫疗法疗效的新方法。
黑色素瘤特异性T细胞
黑色素瘤富含特异性针对黑色素瘤相关抗原的TIL,表明抗黑色素瘤T细胞可以经历启动、扩增、然后重新募集到肿瘤中。黑色素瘤的内源性T细胞反应已被开发用于多种治疗,包括(1)识别同源抗原,然后用于疫苗开发;(2) 用于过继细胞治疗(ACT)的肿瘤特异性T细胞的扩增和/或工程化。
随着1977年IL-2的发现,使T细胞能够在体外扩增以表征其特性,这促进了对黑色素瘤TIL的研究。多种识别黑色素瘤相关肿瘤抗原的T细胞被鉴定出来,这些相关抗原包括:1)癌胚抗原:(如Mage-A1、NY-ESO-1)它们在成人组织中被甲基化并沉默,但肿瘤通常具有异常的DNA甲基化模式,导致去甲基化、异位表达;2)黑素细胞分化抗原:如MART-1、gp100、酪氨酸酶,它们在黑素细胞的正常分化中发挥作用,因此在肿瘤和黑素细胞之间共享。3)过表达抗原:如PRAME;4)新抗原:新抗原源于肿瘤特异性体细胞突变,这种突变在正常人类基因组中不存在,只在癌细胞中表达。5) 其他来源:免疫原性表位也可以来自与基因融合相关的突变、导致内含子保留的异常mRNA剪接或导致隐匿抗原的异常翻译。
总的来说,黑色素瘤特异性TIL的存在表明,在许多情况下(1)这些细胞的数量或功能不足以完全根除肿瘤,(2)它们可以被增强,以达到体内完全根除肿瘤所需的数量。为了实现这一目标,使用体外扩增TIL的ACT被证明有助于肿瘤消退,尤其是在黑色素瘤中。
黑色素瘤的B细胞反应
黑色素瘤抗原也能诱导B细胞反应,进一步支持该疾病的免疫原性。据报道,抗黑色素瘤相关抗原的自身抗体在黑色素瘤患者中产生,并与某些病例的预后改善相关。然而,抗黑色素瘤抗体反应是否在肿瘤保护中发挥因果作用仍有待充分阐明。
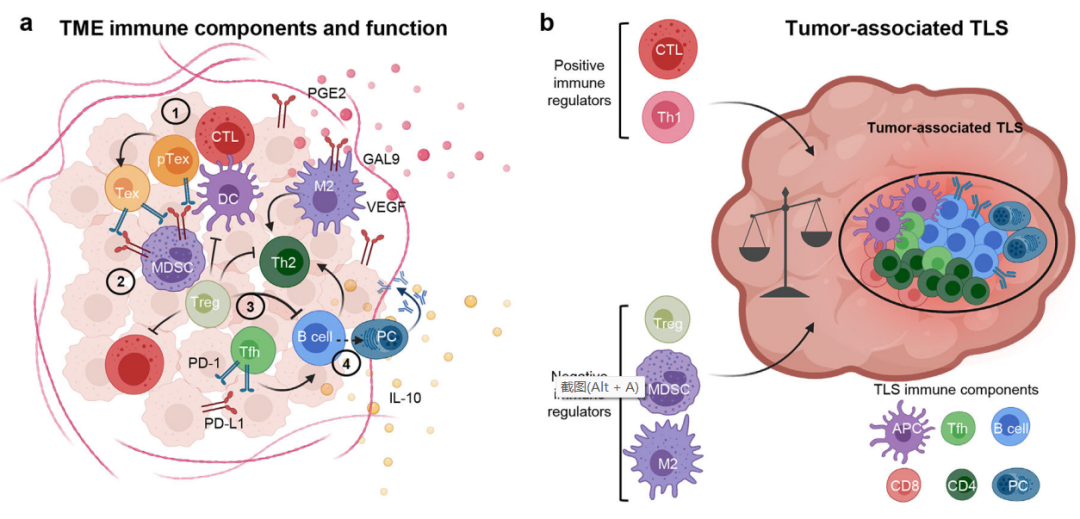
与正常皮肤相比,成熟B细胞在黑色素瘤病变中的出现频率更高,与T细胞和树突状细胞(DC)聚集在一起,构为三级淋巴结构(TLS)。TLS形成的关键介质,包括早期(CXCL13)、中期(淋巴毒素β受体)和晚期淋巴血管生成因子(CCL21,LIGHT),可在转移性黑素瘤中过度表达。黑色素瘤相关抗原引发的慢性免疫原性刺激可能触发TLS支持信号,招募和扩增肿瘤特异性B细胞。B细胞及其抗体产物可能具有高度异质性,其特征从促炎症(IgG1+)到免疫抑制(例如CD1d+IL-10+PD-L1+、IgA+、IgG2+、或IgG4+)。这种异质性可以解释黑色素瘤患者B细胞浸润与阴性预后之间存在明显矛盾的独立研究结果。这些差异也可以由微环境免疫信号的多样性及其对肿瘤内B细胞向促炎或抗炎方向极化的影响来解释。
TLS是高度动态的,也可以吸引免疫抑制细胞,如调节性T细胞(Treg)、未成熟的耐受性DC和/或髓源性抑制细胞(MDSC),以应对过度炎症。精确测量肿瘤相关TLS的免疫刺激和免疫抑制潜能,并根据成分和炎症信号预测其命运的可能性,将为免疫治疗反应提供潜在的有价值的生物标志物。事实上,尽管TLS和肿瘤内B细胞生物学存在许多未知因素,但最近有报道称,这些因素与患者对ICB的反应改善有关。
黑色素瘤的免疫抑制机制
尽管黑色素瘤具有免疫原性,但转移性黑色素瘤通常不会自发消除。对黑色素瘤免疫原性的强烈免疫选择压力可诱导肿瘤适应和抑制抗肿瘤免疫。此外,局部炎症可激活稳态免疫反馈,有助于这种适应性抵抗。例如,肿瘤内CD8+T细胞通过产生CCL22和IFN-γ,分别在肿瘤细胞上诱导PD-L1表达和肿瘤内Treg积聚。
黑色素瘤也可以直接吸引免疫抑制细胞。尤其是通过MHC-II表达,黑色素瘤细胞具有与免疫抑制CD4+T细胞亚群相互作用和吸引的独特能力。黑色素瘤患者的外周血(PB)、淋巴结和肿瘤微环境(TME)中的Treg增加,并被发现抑制TIL功能。最近的单细胞组学研究表明,黑色素瘤浸润的Tregs具有高度克隆性,可以通过TCR:pMHC II相互作用识别肿瘤细胞,这表明黑色素瘤细胞可以直接激活和扩增Tregs,从而控制局部免疫抑制。值得注意的是,发现肿瘤特异性Treg的克隆扩增与新抗原负荷相关,而新抗原负荷又与MHC-II的肿瘤表达相关,进一步指出了黑色素瘤通过MHC-II表达控制Treg扩增的机制,这取决于其免疫原性。
此外,在黑色素瘤患者中,有报道称其倾向于Th2极化的CD4+T细胞和相关细胞因子,Th2免疫偏向是慢性炎症反应的指标。人类黑色素瘤细胞过表达VEGF和galectin-9可通过M2巨噬细胞分化支持这种Th2偏向,从而促进肿瘤促进性炎症。
DC在控制局部炎症、T细胞募集和黑色素瘤的激活方面起着关键作用。多项研究表明,黑色素瘤细胞和局部炎症通过多种机制对肿瘤内DC丰度和共刺激能力产生负面影响,从而限制了有效T细胞反应的产生。
ICB治疗黑色素瘤的最新进展
第一个应用于黑色素瘤治疗的免疫检查点抑制剂是靶向CTLA-4的ipilimumab,在2011年首次获得转移性黑色素瘤的适应症。然后在2014年,PD-1抑制剂pembrolizumab和nivolumab被批准用于转移性黑色素瘤。考虑到CTLA-4和PD-1阻断剂的不同和潜在的互补作用,随后对这些疗法进行了联合试验,证明其对转移性黑色素瘤的长期疗效优于单独使用任何一种药物,49%的患者在6.5年后仍然存活,尽管以更大的毒性为代价。目前正在研究抗PD-1+抗CTLA-4的替代和/或剂量方案以降低毒性。
耗竭T细胞中免疫共抑制受体的发现激发了针对新型免疫检查点分子抗体疗法的进一步发展。最有希望的新型ICB靶标是LAG-3,LAG-3是一种与CD4结构相似的表面抑制性受体,与MHC-II和其他配体(如galectin-3)竞争性结合。与CTLA-4类似,LAG-3也在Treg上组成性过表达,促进其抑制功能。虽然作为单一疗法的LAG-3抑制剂具有中度的抗肿瘤疗效,但联合抗LAG-3+抗PD-1在几种小鼠肿瘤模型中表现出显著增强的治疗活性,包括黑色素瘤。
目前,最领先的抗LAG3抗体是relatlimab。今年3月,FDA 批准 relatlimab联合nivolumab 的固定剂量组合用于治疗 12 岁或以上且患有不可切除或转移性黑色素瘤的成人和儿童患者。临床试验结果表明,relatlimab+nivolumab与nivolumab单药治疗相比,无进展生存率(PFS)更高,relatlimab+nivolumab 组为 10.1 个月,而nivolumab单药组仅为 4.6 个月。
ICB在黑色素瘤中的其他进展来自其对早期疾病的研究,即在手术切除后(辅助治疗)或手术切除前(新辅助治疗)给予ICB。ipilimumab是第一种在辅助治疗中显示出对黑色素瘤持久生存益处的ICB疗法,随后用nivolumab或pembrolizumab阻断PD-1,与安慰剂甚至ipilimumab相比,在高危III期患者中显示出改善的无复发生存率(RFS)。鉴于与ipilimumab相比毒性状况有所改善,PD-1阻断剂已成为辅助治疗的标准护理。最近,pembrolizumab的辅助治疗获得了FDA对II/C期黑色素瘤的批准。
新辅助性ICB也取得了进展,到目前为止,已有五项研究在黑色素瘤中完成。新辅助ipilimumab+nivolumab或单用PD-1阻断剂分别显示33-57%和19-25%的病理完全响应(pCR)率。此外,替代的联合方案也在研究中,新辅助药物nivolumab+relatlimab显示出令人印象深刻的pCR率(59%)。
靶向黑色素瘤代谢以克服免疫治疗耐药性
尽管ICB取得了成功,但这些疗法的疗效,即使是联合治疗,也达到了一个上限,迫切需要新型药物。肿瘤细胞通常适应有氧糖酵解,在TME中,癌细胞比正常免疫细胞具有代谢优势,从而有利于肿瘤进展和免疫逃避。目前,肿瘤代谢正在成为关键的靶向目标,可能应用于联合免疫治疗进行靶向治疗。
代谢竞争在黑色素瘤中尤其相关,人类黑色素瘤糖酵解升高与T细胞浸润和激活以及对ACT或ICB的反应呈负相关。进展性黑色素瘤可以获得维持氧化代谢的高代谢表型,为了对抗这种高代谢表型并加强免疫治疗,抗糖尿病双胍类药物正在黑色素瘤中进行研究,初步回顾性分析显示,ICB治疗期间接受二甲双胍的患者新的脑转移发生率降低,预后良好。

此外,高氧化肿瘤微环境中的氧张力降低可促进对T细胞耗竭和T细胞PD-1抵抗的再活化。相反,微环境中的肿瘤糖酵解和葡萄糖剥夺对CTLA-4阻断剂具有优先作用。氧化性和糖酵解性肿瘤代谢分别对抗PD-1和抗CTLA-4抑制剂的优先抵抗,至少可以部分解释为这些免疫疗法直接靶点的不同细胞定位。PD-1阻断主要作用于重振功能失调的PD-1+T细胞,而CTLA-4阻断在对抗Tregs方面有作用,Tregs在葡萄糖缺乏的环境中稳定性增强。最近的研究表明,靶向Treg中的乳酸或脂肪酸代谢可增强小鼠黑色素瘤模型对ICB的反应。
小结
免疫检查点抑制剂被批准用于晚期黑色素瘤治疗已有十年了。在这十年中,随着我们对人类黑色素瘤免疫微环境的进一步深入理解,我们致力于探索基于免疫检查点抑制剂的新药物和新疗法,取得了不菲的成绩。
然而,随着越来越多的药物可用,我们需要明确联合免疫治疗的机制,以指导合理组合。我们需要关注包括:稳健的生物标志物、耐药机制以及与其他疗法的联合应用。展望未来,新辅助治疗展现出良好的前景。此外,当前和新的免疫治疗组合的毒性仍然是解决的关键点,了解免疫毒性的分子介质将大大有助于控制这些副作用并改善患者的管理。
原文标题 : 从免疫敏感性和耐药性看黑色素瘤检查点阻断免疫治疗的十年






