关注小药说药,一起成长!
前言
阿尔茨海默症(AD)是一种进行性、不可逆的神经退行性疾病,临床表现为认知障碍、行为异常和社会缺陷。据预测,到2050年,美国65岁及以上老年痴呆症患者的数量可能会达到1380万。在中国,超过1507万60岁或以上的老年人患有痴呆症,其中约983万人患有AD。
目前,AD的发病机制还不清楚。β-淀粉样蛋白沉积和tau蛋白过度磷酸化被广泛认为是AD发病的神经生物学机制。此外,其他年龄相关、保护性和疾病促进因素可能与AD的核心机制相互作用,并可能参与AD的发病。
近年来,CRISPR/Cas9的基因编辑技术发展迅速,在基础研究和疾病治疗领域显示出巨大的潜力。最近,基因编辑技术被评估为AD研究和治疗的一种有前途的方法。CRISPR/Cas9在AD模型构建、致病基因筛选和靶向治疗等方面具有极大的应用潜力。
CRISPR/Cas9系统
CRISPR/Cas9系统本质上是一种针对外源DNA的细菌防御机制。CRISPR最初发现于20世纪80年代末,是一种由交替重复和非重复DNA序列组成的不寻常的遗传结构。基因组分析表明,CRISPR和Cas蛋白作为获得性免疫系统发挥作用,并通过RNA引导的DNA切割系统保护原核DNA免受噬菌体和质粒DNA的攻击。
当外源DNA侵入细菌时,其DNA片段作为间隔子并入CRISPR位点。然后将该位点转录到CRISPR前RNA(crRNA),该RNA附着到组成性形成的反式激活RNA(tracrRNA)上,由CRISPR相关蛋白修饰成gRNA。当gRNA与非活性Cas9复合物的REC I结构域结合时,该复合物被激活,导致gRNA及其互补单链DNA形成异源双链。Cas9的HNH和RuvC核酸酶域随后分别切割互补和非互补DNA链。
Cas9属于1类CRISPR-Cas系统的II型,来源于化脓链球菌。Cas9与靶序列的偶联需要一个原间隔基邻近基序(PAM),一个小的入侵基因组中的3-8bp DNA序列,PAM在区分细菌自身和非自身DNA以及成功结合Cas9方面至关重要。
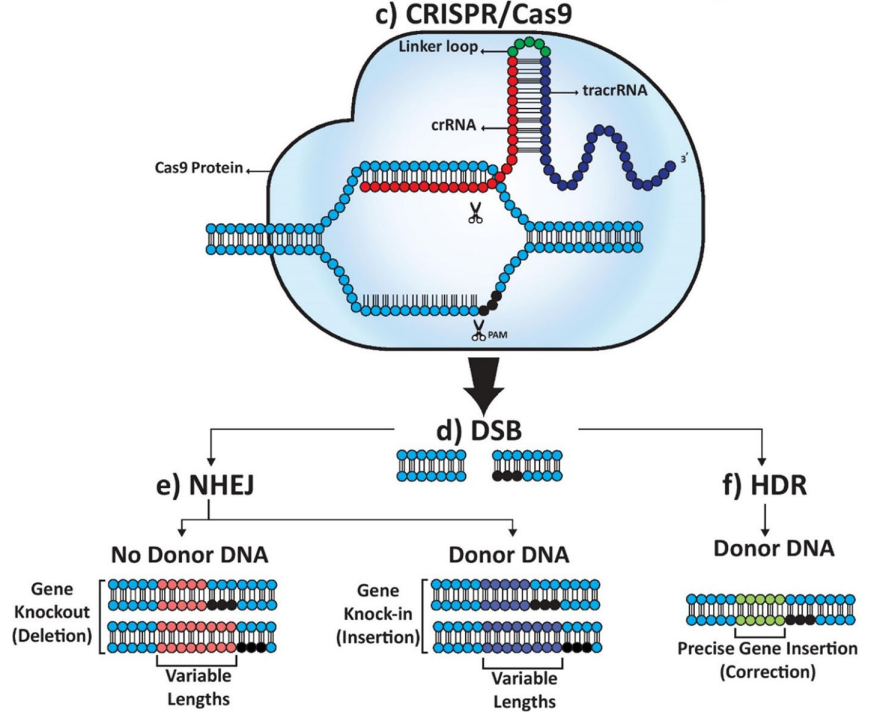
与ZFN和TALEN不同,ZFN和TALEN依赖于每个特定基因序列的精细蛋白质产物,CRISPR/Cas9系统依赖于gRNAs,使其成为更灵活的平台。Cas9蛋白保持不变,而gRNA可以方便地根据每个基因进行定制。CRISPR/Cas9系统的另一个优点是,它使得在多个基因座上同时进行基因编辑成为可能,与以前的系统相比,它提供了一个更高效和可扩展的平台。
CRISPR/Cas9应用于AD模型的构建
细胞模型由于不涉及伦理问题,实验周期相对短,成本低,因此在包括AD在内的各种神经疾病的研究中得到了广泛的应用。在过去的几十年中,建立了许多AD的体外细胞模型。迄今为止,AD研究中常用的细胞系包括人类神经母细胞瘤细胞SH-SY5Y和SK-N-SH、小鼠海马神经元细胞系HT22和胶质细胞BV2以及小鼠胶质母细胞瘤细胞N2a。CRISPR/Cas9基因编辑技术的出现可以促进更有效地开发AD细胞模型。
例如,通过CRISPR/Cas9系统下调HT22细胞中硫氧还蛋白相互作用蛋白(Txnip)水平可有效减弱β-淀粉样蛋白诱导的蛋白质半胱氨酸氧化修饰。研究结果表明,Txnip可能是治疗AD的一个治疗靶点。
除了构建AD细胞模型外,CRISPR/Cas9技术还可用于构建AD动物模型。2020年,Serneels等人通过使用CRISPR/Cas9策略在小鼠和大鼠的APP基因中生成人源化aβ序列(G676R、F681Y和R684H),创建了一个名为Apphu/hu的新模型。通过在啮齿类动物Aβ序列中插入三种氨基酸,Aβ的水平比原始野生型菌株增加了三倍以上。
CRISPR/Cas9应用于AD致病基因的筛选
阿尔茨海默症分为散发性(SAD)和家族性(FAD)。APP、PSEN1和PSEN2是引起FAD的主要致病基因,每个基因的突变都可能导致FAD的发生。然而,95%以上的AD病例是散发性的,SAD致病基因的筛选对于了解AD的分子发病机制、早期诊断、风险预测和治疗至关重要。
高通量测序和CRISPR/Cas9的发展为SAD致病基因的筛选提供了很大的帮助。例如,研究发现,通过CRISPR系统敲除IPSC中的TREM2,小胶质细胞的存活、载脂蛋白E的清除和SDF-1α/CXCR4介导的趋化性都受到严重影响,最终导致对β淀粉样斑块的损伤反应。此外,Duan等人设计了基于成像的阵列CRISPR,用于研究与AD特征相关的基因。这也将提供一个探索AD生物学的平台和药物发现的机会。
CRISPR/Cas9应用于AD的靶向治疗
CRISPR/Cas9靶向APP基因突变
APP基因的突变导致Aβ前体蛋白的β-分泌酶切割增加,从而导致显性遗传性AD。Gyorgy等人报告,当使用CRISPR/Cas9技术敲除APP等位基因时,Aβ蛋白的表达降低。因此,CRISPR/Cas9系统可能为具有APP突变的AD患者提供基因治疗策略。
CRISPR/Cas9靶向Aβ蛋白的关键酶
Aβ蛋白是通过BACE1和γ-分泌酶对APP进行顺序修饰形成的。因此,靶向BACE1和γ-分泌酶是治疗AD的一种潜在治疗策略。Park等人报告,在两种AD小鼠模型中,通过使用CRISPR/Cas9成功降低了BACE1的表达。γ-分泌酶由γ-分泌酶激活蛋白(GSAP)调节,Wong等人利用CRISPR-Cas9技术在稳定表达APP的HEK293细胞中敲除GSAP,导致Aβ分泌和γ-分泌酶活性显著降低。
CRISPR/Cas9靶向编辑载脂蛋白E基因型
APOE4亚型是SAD最强的遗传风险因素。众所周知,APOE主要由中枢神经系统的星形胶质细胞表达。Wadhwani等人关于APOE4治疗靶点的研究表明,当通过CRISPR/Cas9方法将两名AD患者的IPSC中的E4等位基因更正为E3/E3基因型时,E3神经元对离子霉素诱导的细胞毒性不太敏感,并且表现出tau磷酸化的降低。此外,Lin等人利用hiPSC和CRISPR/Cas9技术鉴定了APOE4的功能,他们的结果表明APOE4以不同的方式影响Aβ代谢。这些发现表明APOE4可能是治疗AD的一个有希望的靶点。
CRISPR/Cas9靶向促炎分子
人类基因关联研究表明,免疫反应也是AD病因的主要途径。越来越多的证据表明慢性神经炎症在AD中的重要性。CD33是一种免疫调节受体,在中性粒细胞上高水平表达,在小胶质细胞上低水平表达,在调节AD病理学的吞噬功能方面具有不同的作用。Bhattacherjee等人的最新研究表明,通过CRISPR/Cas破坏CD33基因,并替换为hCD33的保护性变体,可以减轻Aβ病理和神经退行性变。
胶质成熟因子(GMF)是一种新发现的促炎症分子,主要在淀粉样斑块周围的反应性胶质细胞中表达,并在各种AD脑区高度表达。GMF的过度表达通常通过激活p38 MAPK信号通路和氧化毒性导致神经细胞死亡。Raikwar等人通过CRISPR/Cas9方法成功降低BV2细胞中的GMF表达,从而抑制pp38 MAPK以调节GMF诱导的小胶质细胞促炎症反应。
半胱氨酸白三烯(Cys-LTs)是一组炎症脂质分子,通过两种主要的G蛋白偶联受体(CysLT1R和CysLT2R)启动炎症信号级联反应。近年来,越来越多的证据表明CysLT1R与AD的发生和发展密切相关,并可通过NF-κB途径介导炎症反应。Chen等人证明,通过CRISPR/Cas9系统删除CysLT1R可减少APP/PS1小鼠的淀粉样病变并减轻神经炎症。
小结
基因编辑由于其在科学研究和疾病治疗中广泛而有效的应用前景,近年来进入了一个蓬勃发展的时期。最近,已有许多关于CRISPR/Cas9介导的AD相关研究,主要涉及利用该技术构建AD模型、筛选致病基因以及通过特定靶基因(如APP、BACE1、APOE4、CD33、GMF和CysLT1R)治疗AD。然而,考虑到该技术中潜在的非靶向错配和特异性组织靶向性,CRISPR-Cas9最终应用于AD的临床治疗仍面临诸多挑战。
总之,CRISPR/Cas9作为本世纪的基因编辑技术的突破性进展,为临床基因治疗开辟了新的途径。与其他基因编辑技术相比,CRISPR-Cas9系统具有周期短、细胞毒性低、价格低廉、传递简单等优点。因此,尽管考虑到仍存在一些缺点,CRISPR-Cas9系统在AD的临床治疗中仍具有广阔的应用前景。
参考文献:
1. Application of CRISPR/Cas9 in Alzheimer’sDisease. Front Neurosci. 2021; 15: 803894.

原文标题 : CRISPR/Cas9在阿尔茨海默症中的应用前景













