前言
随着肿瘤免疫治疗时代的到来,众多新的治疗靶点纷纷纷涌而出。CD39是一种胞外酶,与CD73一起负责将三磷酸腺苷级联转化为二磷酸腺苷和环磷酸腺苷,最终导致在肿瘤微环境中释放免疫抑制形式的腺苷。腺苷已被公认为抗肿瘤免疫的重要调节因子。
目前,针对腺苷途径各种成分的选择性抑制剂进入临床开发,包括针对高亲和力A2A腺苷受体和低亲和力A2B受体的小分子拮抗剂、治疗性单克隆抗体(mAb)和针对CD73的小分子以及针对CD39的抑制性抗体。因此更好地理解每一种靶向治疗方法的作用机制将有助于加速临床转化,并改进联合治疗的设计策略。
肿瘤微环境中的腺苷途径
CD39是一种胞外酶(胞外核苷酸三磷酸二磷酸水解酶1,由ENTPD1基因编码),属于胞外核苷酸酶家族,包括胞外-5′-核苷酸酶(NT5E)/CD73、CD38/NADase、NAD糖水解酶、核苷二磷酸激酶、胞外核苷酸焦磷酸磷酸二酯酶(E-NPPs),胞外核苷三磷酸二磷酸水解酶(ENTPDase)和腺苷酸激酶。
CD39与CD73的酶活性一起,负责ATP转化为二磷酸腺苷(ADP)和环磷酸腺苷(cAMP)的级联反应,最终生成细胞外腺苷。腺苷途径通过1型嘌呤能受体(A1、A2A、A2B、A3)发生,这些受体属于G蛋白偶联受体(GPCR)。A1和A3受体抑制腺苷酸环化酶和cAMP生成,它们通常被描述为促进免疫的腺苷受体。相反,A2A和A2B受体通常与高水平的免疫抑制相关,触发细胞内cAMP积累。A2A和A2B受体在不同的免疫细胞中都有大量表达,包括髓系细胞和淋巴细胞。
各种类型的细胞可能通过指定的通道释放ATP到微环境中,或由于死亡或应激细胞坏死而释放ATP。高水平的胞外ATP(eATP)通过P2受体(P2Y和P2X家族)的参与提供了强大的炎症信号,P2受体对先天性和适应性免疫反应的激活至关重要。因此,CD39上调是肿瘤通过耗尽肿瘤微环境(TME)中的免疫刺激性eATP 来逃避抗肿瘤策略的有效机制。
CD39/CD73的表达
已观察到CD39在不同的人类肿瘤类型中过度表达,如肾细胞癌、卵巢癌、肉瘤癌、乳腺癌、淋巴瘤、膀胱癌、结肠癌和黑色素瘤。内皮细胞、癌相关成纤维细胞(CAF)和一些免疫亚群,特别是自然杀伤(NK)细胞、肿瘤相关巨噬细胞(TAM)和肿瘤浸润淋巴细胞(TIL),包括Tregs和CD8+T细胞,也有报道称其水平升高。CD39高表达被认为是不良预后和疾病进展的标志。
eATP和细胞外腺苷水平也受CD73表达的调节,CD73是将AMP转化为腺苷的胞外酶。CD73经常在人类肿瘤中表达,特别是在肿瘤细胞、CAF和内皮细胞中,但也在髓样细胞、NK细胞和T细胞中表达。大多数数据描述了CD73水平升高与不良临床结果之间的强相关性,与CD39类似。通过CD39和CD73的阻断,可能限制ATP/AMP转化为腺苷,许多临床前和临床研究表明,肿瘤生长和转移形成受到抑制,通常与NK和/或CD8 +T细胞免疫介导的抗肿瘤反应增加有关。
CD39在CD4+T细胞和Treg中的功能
CD39被描述为FOXP3+ Treg的主要标志物,其细胞外ATP的水解对于其免疫抑制功能至关重要。对ENTPD1缺陷(CD39-/-)小鼠的体外和体内研究表明,Treg抑制功能受损。腺苷触发的信号可能增加细胞内cAMP水平,导致ENTPD1启动子的反式激活,从而增加和稳定Treg中CD39的表达。与此一致,在多发性硬化症(MS)患者中观察到CD39+FOXP3+Treg数量减少,表明Treg中的CD39表达在控制炎症性自身免疫性疾病中的重要性。相反,癌症患者的循环CD39+CD25+Treg水平升高,低水平的CD39+Treg与黑色素瘤患者的无复发生存率提高相关。
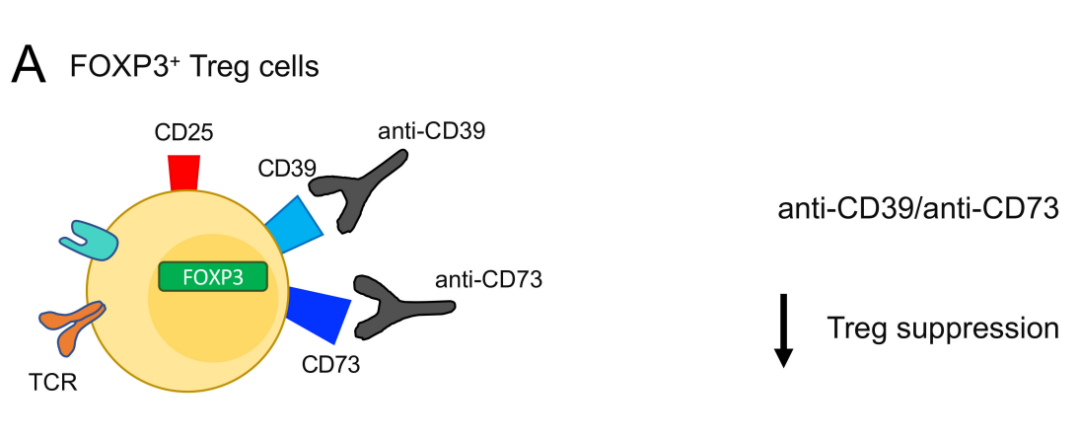
此外,在肿瘤浸润性Treg细胞中观察到的CD39水平升高,通常伴随着其他抑制/激活标记物(即OX40、PD-1、CTLA-4)水平升高。所有这些观察结果表明,CD39在抑制肿瘤免疫反应中起着关键作用。
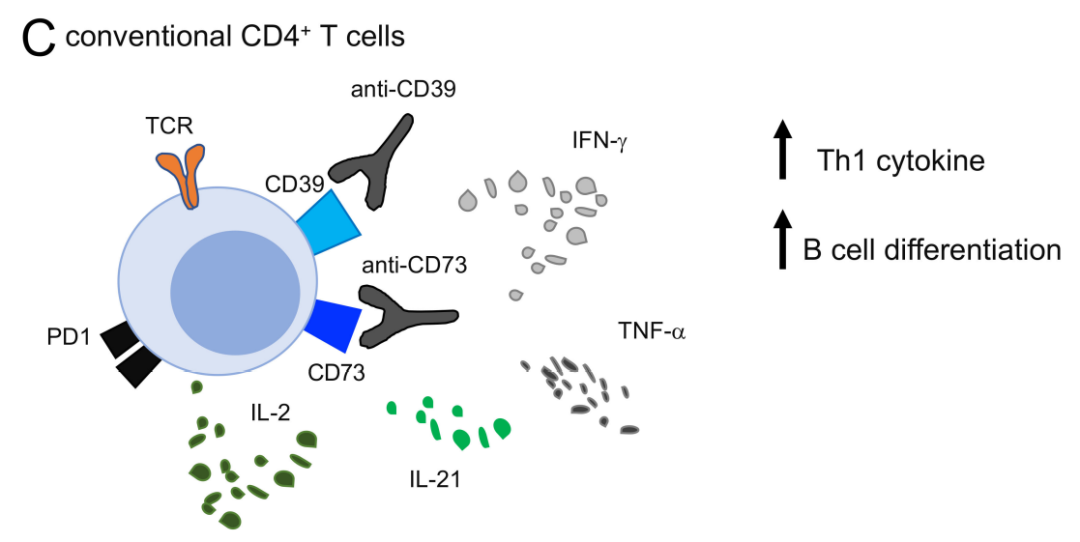
CD39也可能在常规FOXP3–CD4+T细胞中表达。例如,在鳞状细胞癌患者中,CD39+cCD4+T细胞显示出肿瘤特异性抗原反应性。有趣的是,表达CD39的cCD4+T细胞通常与辅助性T细胞(Th)17效应器功能相关。已知Th17细胞可促进慢性炎症并调节肠道内的共生细菌。另一方面,表达CD39的Th17细胞与IL-10生成增加有关,而CD39+Th17细胞预测癌症患者的临床预后较差。
CD39在CD8+T细胞中的功能
最近有报道称CD39在CD8+T细胞中表达,并将CD39描述为耗竭的标志。研究证明,CD39表达可以识别在HCV和HIV慢性感染中最终耗竭的病毒特异性CD8+T细胞。肿瘤浸润性CD39hiCD8+T细胞显示低TNF?α、IFN-γ和IL-2的分泌。CD39表达伴随着共抑制受体(即LAG3、TIGIT、PD1、TIM3、2B4),并与肿瘤进展相关。
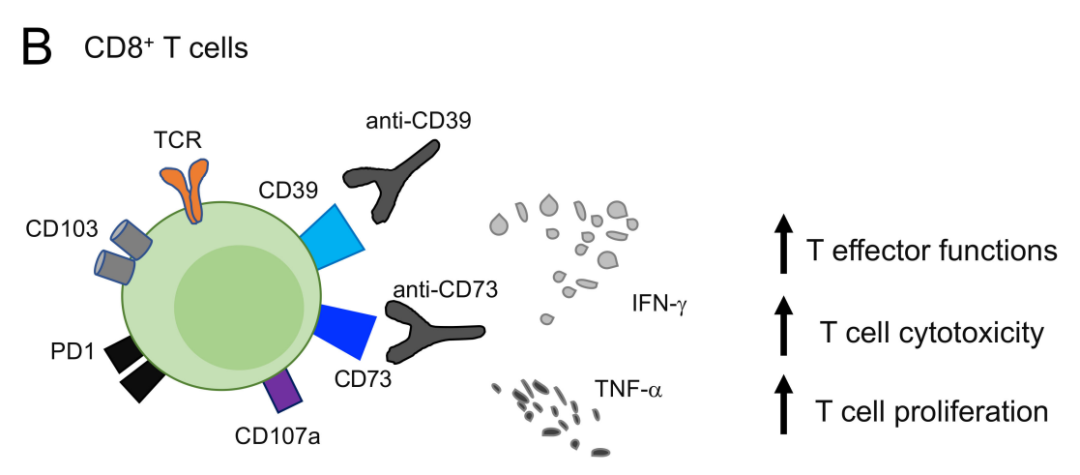
然而,一些研究认为表达CD39的CD8+T细胞具有调节特性。尽管CD8+Treg在过去30年中已被广泛研究,但其标记物尚未完全阐明。研究显示,CD39可能参与调节肿瘤浸润性CD8+Treg的抑制能力,分离的CD39+CD8+T细胞确实能够在体外抑制T细胞增殖。此外,CD39的拮抗显著抑制了CD8+Tregs的抑制能力,突出了其在介导抑制功能中的关键作用,这也适用于CD4+Tregs。
综上所述,这些数据表明,CD39被抗原驱动上调、激活CD8+Treg细胞的内在抑制功能,来调节过度免疫病理反应。这种调节机制在需要避免过度免疫反应的情况下可能是有益的,例如,在感染恢复后。相反,它在肿瘤条件下会造成损害,即通过提供肿瘤特异性CD39+CD8+T细胞的抑制能力。
细胞因子对CD39的调节
目前,对于CD39在特定情况下在FOXP3+Tregs、cCD4+和CD8+T细胞中上调的机制知之甚少。与循环中的细胞相比,肿瘤浸润的CD4+和CD8+T细胞中的CD39表达会显著增加,这表明TME中的特殊因素可能导致CD39水平升高。
体外研究表明,TCR结合和IL-2可增加CD39的表达。此外,发现TGF-β可能诱导CD39+Tregs的扩增,TGF-β/SOX4信号通路在ROS驱动的自噬参与下,被证明介导了Treg中CD39的表达。在小鼠的动物模型中发现,IL-27信号通过STAT-1依赖机制直接驱动Tregs中CD39的表达,IL-35也可能参与诱导Treg中CD39的表达。
尽管TCR参与足以上调CD39,但IL-6和IL-27的暴露进一步促进了CD39在人类和小鼠CD8+T细胞中的表达。在食管鳞状细胞癌的肿瘤浸润NK细胞中,IL-6也可诱导CD39的表达,这表明在几种免疫细胞中,存在广泛的IL-6介导CD39表达的调节机制。在参与CD8+T细胞CD39上调的因素中,IL-12和IL-4也是重要的参与者。
CD39受遗传因素的调节
在人类中,循环T细胞的数量在某种程度上是可遗传的,这是遗传因素在平衡免疫反应中的重要基础。此外,Treg的遗传结构在很大程度上由几个单核苷酸多态性(SNP)决定。
位于rs10748643位置的SNP可能影响T细胞中CD39的表达水平。其中A等位基因决定了较低的CD39水平,而G等位基因则显示较高的CD39水平。与AA型相比,具有GG变体的受试者对炎症反应的控制更好,病理效应细胞产生的IL-17和IFN-γ更少。与这一发现一致,与低CD39表达相关的SNP与克罗恩病易感性增加有关。
位于rs_10748643位置的SNP也与cCD4+T细胞中较低或缺失的CD39细胞表面表达相关。与AG或GG个体相比,AA型不易通过CD3/CD28刺激上调CD39,从而影响体内T细胞对疫苗接种的反应。事实上,具有AA变体的个体对不同的流感病毒株表现出更高的特异性T细胞反应。
有趣的是,CD39作为一个负调节的检查点,抑制辅助性滤泡T细胞(Tfh)的生成。研究表明BCL6(Tfh的谱系决定转录因子)能够抑制CD39的表达。此外,在ENTPD1抑制型的SNP人群中观察到Tfh频率的增加。因此,通过降低CD39的表达,Tfh的生成和生发反应得到增强。
靶向腺苷途径的免疫治疗策略
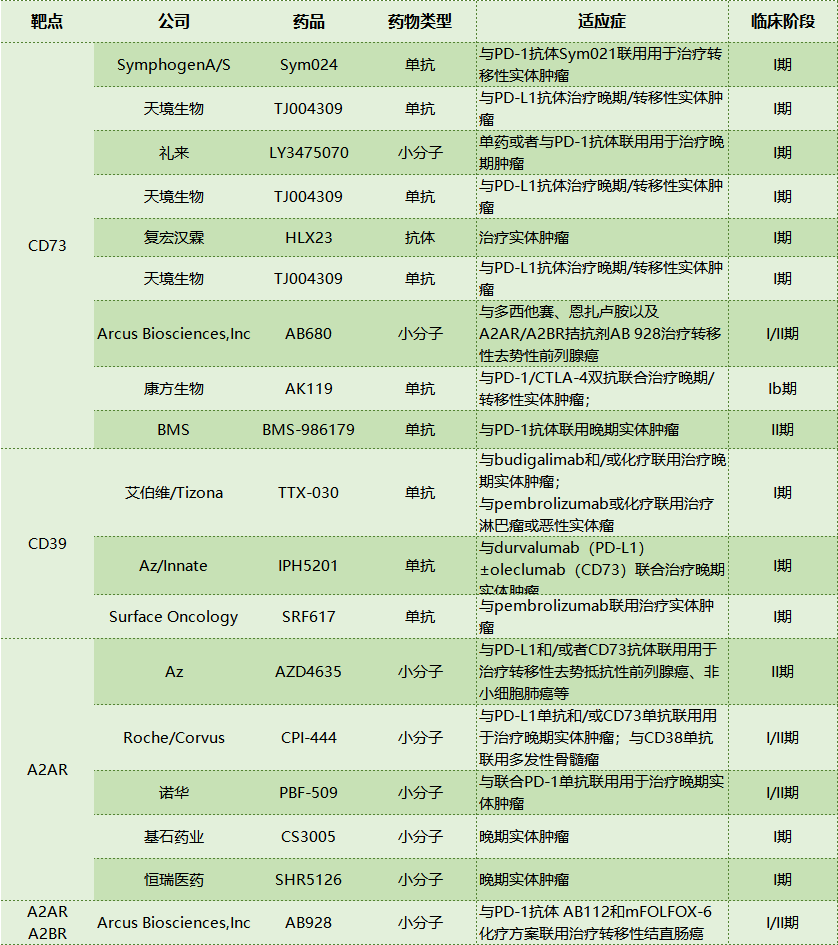
近年来,针对腺苷途径成分的临床试验数量有所增加,但大多数试验仍处于开发的早期阶段。目前包括诺华、AZ、礼来、BMS、罗氏等在内的各大药企均积极布局着腺苷途径的药物研发,尚处于临床阶段,没有获批上市的药物,进展最快的药物研发为临床II期。
TTX-030是TizonaTherapeutics开发的靶向CD39的单克隆抗体。两项随机临床试验NCT03884556和NCT04306900分别发布于2019年3月和2020年3月,旨在研究其安全性和初步疗效,作为单一疗法和与经批准的抗PD-1免疫疗法(Pembrolizumab/Budigalimab)或标准化疗(多西紫杉醇、紫杉醇和吉西他滨)联合使用。同样,Innate公司最近开发了一种CD39阻断抗体(IPH520),并开始临床试验(NCT04261075),作为单一疗法和与抗PD-L1(Durvalumab)或抗CD73(Oleclumab)联合应用。
来源bioseedin柏思荟
国内药企也在积极布局该领域的药物研发,康方生物、复宏汉霖、天境生物研发的靶向CD73抗体已经在临床I期,恒瑞和基石研发的A2AR拮抗剂药物也于去年进入临床I期。科望医药研发的靶向CD39药物已经进入临床前研发阶段,在动物体内药效实验中展现了很强的抑制肿瘤生长的功能,百济神州、再极医药在积极开发A2aR拮抗剂,已经有相关专利申请。
小结
尽管ICI疗法在肿瘤免疫治疗中显示出强劲的疗效,但只有约30%的患者对ICI有响应,这表明有相当一部分患者无法产生保护性或有益的反应。ICI治疗后与免疫抑制相关的机制之一可能是死亡的肿瘤细胞,由于eATP/腺苷释放而导致免疫抑制。因此,将ICI与经典化疗和/或CD73和CD39阻断剂相结合,可能提高治疗的疗效。此外, CAR-T技术作为抗肿瘤的新兴手段,T细胞可以选择性地被改造成缺乏CD73/CD39或腺苷受体,从而改善其抗肿瘤效应器功能。总之,由于其在不同类型肿瘤中的上调表达以及对肿瘤免疫的广泛调节作用,靶向CD39目前是免疫肿瘤学中最有前景的方法之一。
参考文献:
1.CD39 Regulation and Functions in T Cells. IntJ Mol Sci. 2021 Aug; 22(15): 8068.








