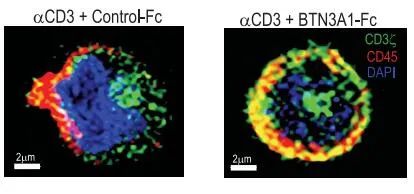
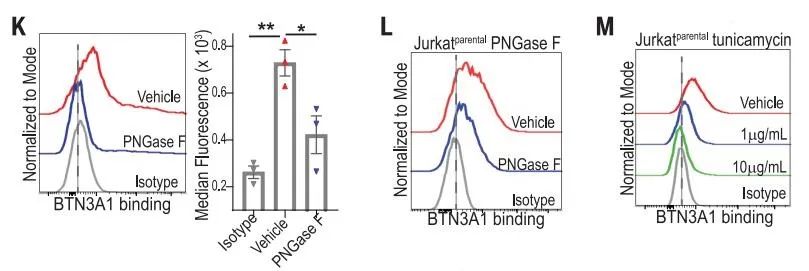
此外,研究发现肽N-糖基化酶(PNGase)F-处理(N-去糖基化)的初级T细胞、CD45+Jurkat细胞以及异位表达CD45RA和CD45RO的CD45-Jurkat细胞均显示与BTN3A1 Fc蛋白的结合显著降低,而CD45的表面表达保持完整。使用N-聚糖抑制剂衣霉素也获得了类似的结果,这些结果都表明了BTN3A1与CD45结合的N-糖基化依赖的机制。
抗BTN3A1诱导协同T细胞反应在体内抑制了卵巢肿瘤生长
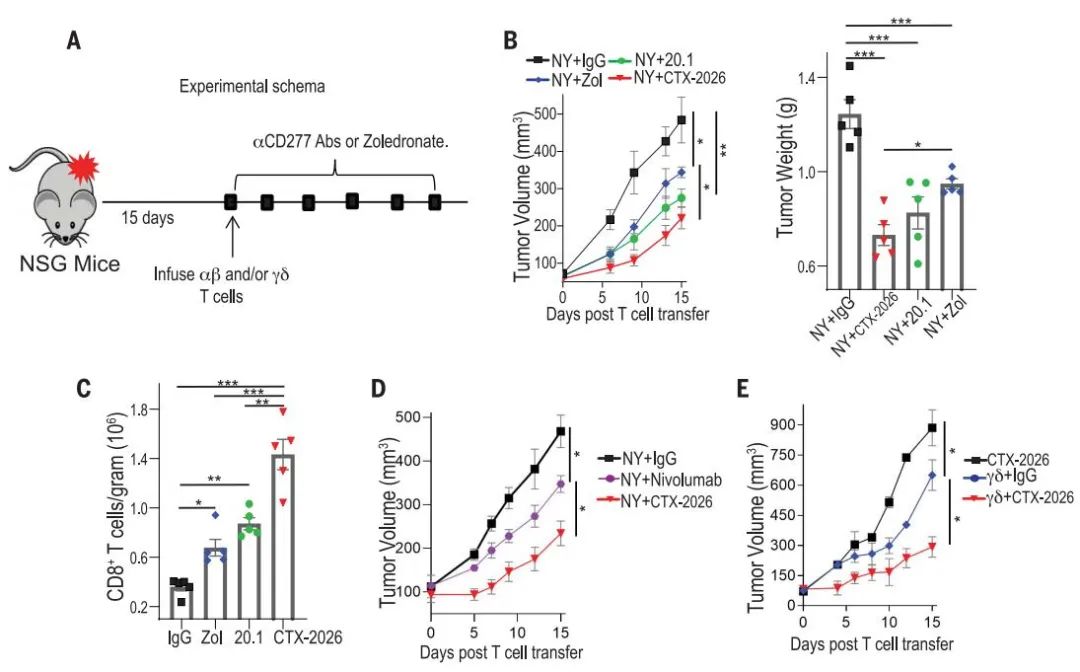
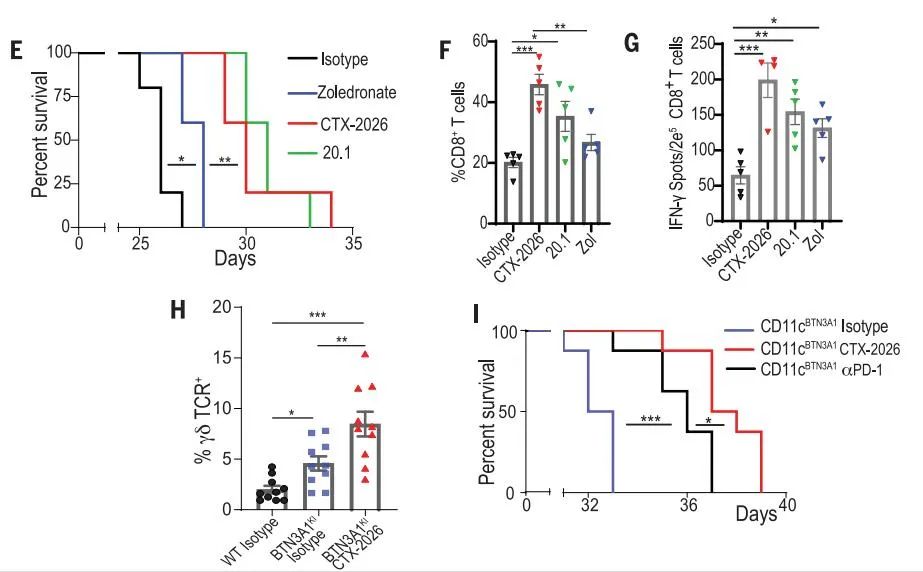
为了评估利用CTX-2026靶向BTN3A1的潜力,试验人员进行了小鼠的体内试验。与对照相比,用CTX-2026抗体阻断BTN3A1可延缓9个不同供体肿瘤的恶性进展(在10个独立实验中),并且比唑来膦酸盐更有效。与对照IgG治疗小鼠相比,CTX-2026诱导的优越治疗效果与肿瘤内抗原反应性CD8+T细胞的积聚显著增加有关。当与肿瘤反应性T细胞结合时,CTX-2026比抗PD-1抗体nivolumab更有效,尽管体内NY-OVCAR3肿瘤细胞上调PD-L1。值得注意的是,所有实验中的肿瘤允许生长至少15天,并通过单次T细胞注射进行治疗,在过继转移时,大至300 mm3的肿瘤具有显著的生长延迟。
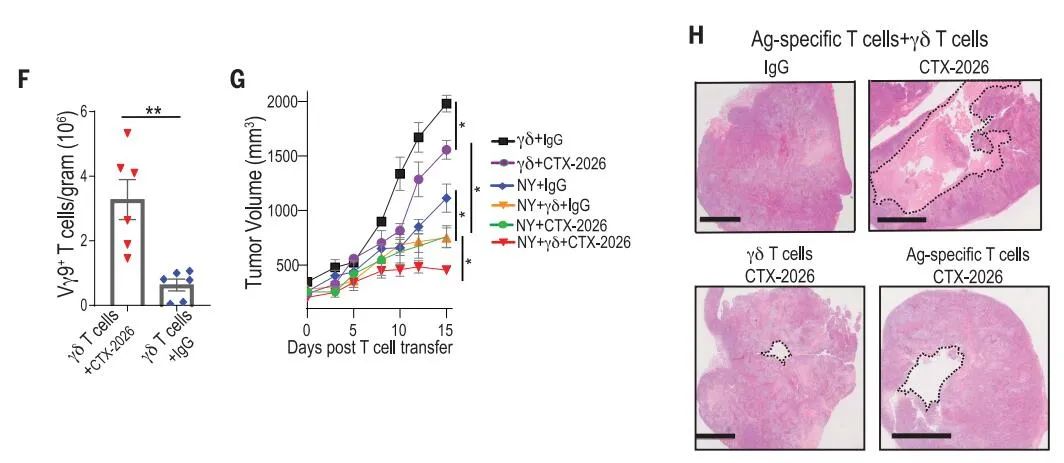
值得注意的是,CTX-2026在体内的保护作用并不局限于肿瘤反应性αβ-T细胞,因为来自8个不同供体的γδ-T细胞与CTX-2026抗体结合使用也能诱导肿瘤生长减缓。相应地,BTN3A1靶向导致肿瘤床内Vγ9-T细胞大量积聚。然而,只有将γδ和肿瘤特异性αβ-T细胞联合给与NY-OVCAR3荷瘤NSG小鼠中,并结合CTX-2026,才能实现对既定肿瘤的最大抗肿瘤响应,并且优于唑来膦酸盐治疗。这种治疗引起肿瘤内囊腔的形成,表明肿瘤部分排斥反应。因此,以BTN3A1为靶点,协调从BTN3A1介导的免疫抑制中恢复的肿瘤反应性αβ-T细胞和细胞毒性Vγ9Vδ2 T细胞,使这些T细胞被重定向以杀死BTN3A1+肿瘤。
此外,研究人员在BTN3A1KI 小鼠腹腔注射构建了原位ID8-Defb29/Vegf-a肿瘤模型(一种对检查点抑制剂有反应并引起促肿瘤的CD11c+髓样细胞积聚的侵袭性模型)。可以预见的是,与对照组相比,BTN3A1KI 小鼠在腹水中积聚了BTN3A1+树突状细胞,并且显示出加速的恶性进展。用唑来膦酸盐治疗携带肿瘤的BTN3A1KI 小鼠延长了生存期,但其程度低于CTX-2026抗体的治疗,肿瘤内CD8+T细胞积聚也存在相应差异。因此,在IFN-γ酶联免疫吸附斑点(ELISpot)分析中,腹膜T细胞对同源肿瘤抗原的反应频率因所有BTN3A1靶向疗法而增加,CTX-2026的读数最高。小鼠γδ-T细胞以CTX-2026依赖的方式积聚在BTN3A1KI 荷瘤小鼠的腹水中。在另一个人源化模型中,靶向BTN3A1比中和PD-L1/PD-1检查点更有效地延缓了肿瘤恶性进展。因此,BTN3A1靶向治疗克服了卵巢癌高度免疫抑制的微环境,而卵巢癌是一种迄今为止对现有检查点抑制剂具有耐药性的疾病。
小结
通过以上试验,可以发现靶向BTN3A1的抗体足以诱导αβ和γδ-T细胞协同抗肿瘤反应,并且靶向BTN3A1在卵巢癌原位异种移植和同基因模型中优于PD-1检查点的治疗。大多数人类恶性肿瘤对现有的检查点抑制剂仍然具有抗药性,这些抑制剂的目的是拯救αβ-T细胞的反应。然而,γδ-T细胞也渗透到多种人类癌症中,它们主要起调节作用。因此,使这两个T细胞亚群的合作可以扩大癌症患者从免疫治疗中受益的范围。
此外,在PD-L1+的人源化模型中,BTN3A1靶向比PD-1中和在αβ-T细胞中更有效,由于γδ-T细胞也表达PD-1,因此确定对检查点抑制剂有反应的患者是否也有协同作用是很有趣的。然而,与PD-L1不同,BTN3A1不需要特定的受体来调节其免疫抑制活性。另外,至少在卵巢癌中,BTN3A在髓系和肿瘤细胞中的过表达与加速的恶性进展有关;因此,BTN3A1靶向可能与其他检查点抑制剂结合以增强免疫治疗反应。
参考文献:
BTN3A1 governs antitumor responses by coordinating αβ and γδ T cells. Science. 2020 Aug 21;369(6506):942-949.








