前言
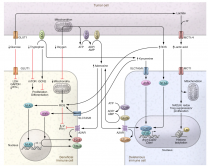
肿瘤和免疫细胞的代谢重编程之间的影响是肿瘤免疫应答公认的的决定因素之一。越来越多的证据表明,肿瘤代谢不仅在维持肿瘤发生和生存中起着关键作用,而且还可以通过释放代谢产物来影响免疫分子(如乳酸、PGE2、精氨酸等)。实际上,肿瘤和免疫细胞之间的这种能量相互作用导致了肿瘤生态系统中的代谢竞争,限制了营养的有效供给,并导致微环境酸中毒,从而阻碍了免疫细胞的功能。更有趣的是,在维持体内各种类型免疫细胞稳态的过程中,代谢重编程也是必不可少的。目前,越来越多的研究指出,免疫细胞在增殖、分化和执行效应器功能的过程中会发生代谢重编程,这对免疫应答至关重要。因此,了解肿瘤细胞和免疫细胞的代谢重编程如何调节抗肿瘤免疫反应,可以使我们在抗肿瘤免疫治疗中寻找到靶向代谢途径的治疗手段。
肿瘤细胞代谢
能量代谢重编程通过调节能量代谢促进细胞快速生长和增殖,被认为是肿瘤细胞的独特标志。由于肿瘤是一种异质性疾病,其细胞和结构的异质性使其具有复杂的代谢模式。
事实上,肿瘤细胞主要利用糖酵解途径快速提供ATP供自身生长,也通过磷酸戊糖途径(PPP)和丝氨酸代谢途径为细胞复制提供生物大分子。即使在充足的氧气条件下,肿瘤细胞仍优先利用糖酵解产生ATP,这是众所周知的有氧糖酵解(Warburg效应)。

同时,肿瘤细胞不仅会分解葡萄糖提供ATP,还会利用谷氨酰胺、丝氨酸、精氨酸、脂肪酸和脂类物质促进自身增殖。有趣的是,肿瘤细胞会根据外界营养物质的浓度和不同的应激条件,选择不同的代谢方式产生供自身使用的ATP和生物大分子。
例如,在葡萄糖或谷氨酰胺等营养缺乏的应激条件下,肿瘤细胞通过调节PHGDH、PSAT1等代谢酶的表达,激活癌基因c-Myc,支持肿瘤细胞的生存,PSPH和丝氨酸合成途径中的其他代谢酶,增强丝氨酸的从头合成并维持氧化还原稳态。此外,在缺氧或营养不足的应激条件下,肿瘤细胞通过摄取最小的双碳脂肪酸(如乙酰乙酸)产生乙酰辅酶A,为自身生存提供能量,并通过生物大分子(如脂肪酸)促进自身生存。同样,肿瘤细胞还通过酮体分解产生的代谢物可以进入TCA(三羧酸)循环,为细胞生存提供ATP。因此,肿瘤细胞的代谢模式是复杂多变的,它会根据不同的环境选择适合自身生存的最佳代谢模式。
免疫细胞代谢
免疫系统包含多种免疫细胞,如巨噬细胞、中性粒细胞、单核细胞、嗜酸性粒细胞、嗜碱性粒细胞、淋巴细胞和自然杀伤细胞。当身体处于稳定状态时,这些细胞处于静止状态,当身体受到感染、炎症或其他外部物质的刺激时,这些细胞会迅速被激活并作出反应。
有趣的是,类似肿瘤细胞的复杂代谢模式也存在于免疫细胞中。最近的研究表明,在静息状态和激活状态下,免疫细胞的能量消耗存在显著差异。例如,幼稚T细胞的新陈代谢基本上是静态的,显示出零增殖,因此只需要维持最基本的营养素摄入、最小的糖酵解速率和最小的生物合成。ATP主要由氧化磷酸化(OXPHOS)产生。一旦被外部刺激激活进入效应T细胞(Teff),它就表现为代谢激活状态,增加营养吸收,增加糖酵解速率,蛋白质、脂质和核苷酸的合成积累。同时,线粒体耗氧量降低,最终T细胞获得生长增殖能力,产生子代细胞,发挥杀伤作用。
此外,活化的中性粒细胞、M1巨噬细胞、iNOS表达的树突状细胞(DC)主要依靠糖酵解提供能量。调节性T细胞(Treg)、M2巨噬细胞主要依靠脂肪酸氧化(FAO)产生的氧化磷酸化来提供能量。不同的代谢模式也影响不同免疫细胞亚群的分化。

肿瘤细胞与免疫细胞之间的营养竞争
代谢转换不是癌细胞独有的,也是其他快速增殖细胞的特征,如活化T细胞、Treg细胞、中性粒细胞等。葡萄糖是肿瘤细胞吸收和消耗最多、依赖性最强的营养物质,也是免疫细胞活化、分化和功能所必需的重要能量物质。
研究发现,肿瘤可通过竞争性摄取葡萄糖抑制肿瘤浸润T细胞的功能,即使有足够的肿瘤抗原供T细胞识别。此外,肿瘤细胞的糖酵解活性可能会限制TIL细胞的葡萄糖消耗,从而导致T细胞衰竭和免疫逃逸。

虽然肿瘤微环境下葡萄糖的竞争性摄取是T细胞功能受损的原因,但氨基酸、谷氨酰胺、脂肪酸和其他代谢物或生长因子以及细胞表面相应转运体的表达同样是影响免疫细胞功能的重要因素。此外,高水平的乳酸和低pH值、缺氧和高水平的ROS在TME中同样普遍存在,最终导致肿瘤进展和免疫逃逸。因此,靶向肿瘤中的这些代谢途径可能是克服肿瘤和免疫系统之间代谢竞争的有害影响,增强肿瘤免疫原性的一种有希望的策略。
肿瘤代谢产物对肿瘤免疫的影响
除了营养消耗外,肿瘤细胞产生的代谢物也会对微环境中的免疫细胞产生深远影响。

乳酸
肿瘤的异常糖酵解是指肿瘤细胞即使在氧气充足的情况下,也会消耗大量的葡萄糖并产生大量的乳酸,相应的OXPHOS生成率较低。乳酸在细胞中积累,然后通过激活细胞膜上的单羧酸转运蛋白(MCT),特别是单羧酸转运蛋白4(MCT4)输出到细胞外环境,最终形成酸性TME。TME的低pH值已被证明有利于选择更具侵袭性的肿瘤细胞,并抑制肿瘤免疫以促进肿瘤进展。
此外,最近的临床研究发现,随着患者肿瘤负荷的增加,血清乳酸水平显著升高。实际上,肿瘤细胞产生的乳酸可能通过促进IL-23和IL-17介导的炎症而促进肿瘤的发生。除了调节免疫反应外,肿瘤相关成纤维细胞(CAF)产生的乳酸也可以被肿瘤细胞用作替代营养源。
乳酸还会影响NK细胞的功能,进而损害IFN-γ的分泌。机制研究表明,NK细胞过量摄入病理浓度的乳酸可引起细胞内酸化,抑制活化T细胞核因子(NFAT)信号的上调,导致NFAT调节的IFN-γ产生减少,促进细胞凋亡。
谷氨酰胺
谷氨酰胺代谢作为一个整体是肿瘤细胞代谢的关键因素。谷氨酰胺对核苷酸合成、氨基酸生成、氧化还原平衡、糖基化、细胞外基质生成、自噬和表观遗传学非常重要。研究表明谷氨酰胺在正常细胞和癌细胞的生长中起着重要作用。在营养缺乏的情况下,癌细胞可以通过分解大分子获得谷氨酰胺。
除了肿瘤细胞外,谷氨酰胺在免疫细胞中有很高的利用率,以支持细胞命运决定和免疫反应,如淋巴细胞、巨噬细胞和中性粒细胞,缺乏谷氨酰胺可抑制T细胞增殖和细胞因子的产生。此外,谷氨酰胺代谢在激活免疫细胞和调节CD4+T细胞向炎症亚型转化中起着重要作用。
谷氨酰胺在巨噬细胞和中性粒细胞中有很高的利用率,随着谷氨酰胺利用率的增加,免疫细胞凋亡率明显降低。通过阻断肿瘤细胞内的谷氨酰胺途径,增加肿瘤微环境中氨基酸的含量,可以增强免疫细胞的杀伤作用。这提示以谷氨酰胺代谢为靶点可能成为治疗癌症的新方法。
PGE2
花生四烯酸是一类重要的二十碳五烯酸,与肿瘤细胞必需脂肪酸有关,是合成前列腺素的重要底物。PGE2是细胞内重要的细胞生长调节因子,也是炎症反应中一种高度活跃的炎症介质,也可以作为免疫抑制因子参与免疫反应。肿瘤相关成纤维细胞衍生的PGE2或其他来源的PGE2可通过刺激血管生成、细胞侵袭和转移诱导肿瘤细胞侵袭并参与肿瘤进展,并通过多种信号途径抑制细胞凋亡以促进细胞存活。
此外,PGE2还可以通过自分泌和旁分泌的方式影响微环境中的其他细胞,破坏免疫反应。例如,PGE2通过抑制Th1分化、B细胞功能、T细胞活化和过敏反应来抑制免疫反应,此外,PGE2还可以对自然免疫细胞,如中性粒细胞、单核细胞和自然杀伤细胞发挥抗炎作用。更重要的是,肿瘤细胞分泌的PGE2的积累可以将具有抑瘤作用的M1巨噬细胞转化为促进癌症的M2巨噬细胞。肿瘤细胞分泌的PGE2也能刺激髓系细胞分泌促癌因子CXCL1、IL-6和粒细胞集落刺激因子(G-CSF),抑制脂多糖(LPS)刺激的髓系细胞分泌TNF-α和IL-12,抑制I型干扰素依赖的天然免疫细胞的活化,并抑制T细胞靶向肿瘤抗原,从而达到免疫逃逸和肿瘤发生的目的。
精氨酸
大多数肿瘤细胞缺乏ASS1(精氨琥珀酸合成酶1),这是一种产生精氨酸的关键酶,因此会导致细胞内精氨酸合成能力的丧失。在这种情况下,肿瘤细胞会利用外源性精氨酸来弥补精氨酸的缺乏所造成的细胞内关键代谢酶的缺乏。有趣的是,精氨酸代谢在T细胞活化和调节免疫反应中也起着至关重要的作用。
在细胞内,精氨酸主要通过精氨酸酶(ARG)和一氧化氮合酶(NOS)的反应生成尿素、L-鸟氨酸和一氧化氮。研究报告,在TME中积聚表达ARG1的免疫调节细胞,包括M2样肿瘤相关巨噬细胞(TAM)、耐受性DC和Treg细胞,可能通过降解精氨酸抑制抗肿瘤免疫,从而限制T细胞对这种氨基酸的利用。
更重要的是,有研究指出,肿瘤细胞在肿瘤微环境中吸收的精氨酸主要由髓系细胞提供(巨噬细胞、单核细胞、髓系抑制细胞、中性粒细胞等)。这意味着肿瘤细胞会消耗TME中大量的精氨酸,从而导致TME中精氨酸的缺乏,因此抗肿瘤免疫细胞的激活必然受到抑制。因此,补充精氨酸和防止精氨酸在TME中降解是重新激活T细胞介导和NK细胞介导免疫应答的非常具有吸引力的策略。
色氨酸
色氨酸是生物体进行蛋白质合成和其他生命代谢活动所必需的氨基酸。实际上,色氨酸降解主要是由两种不同的双加氧酶:IDO1(吲哚胺-2,3-双加氧酶)和TDO2(色氨酸-2,3-双加氧酶)将色氨酸转化为犬尿酸。这些色氨酸降解酶在肿瘤细胞中的高水平表达可促进肿瘤进展,并与胃腺癌患者的不良预后相关。
由于T细胞的活化对周围环境中色氨酸的浓度极为敏感,微环境中的色氨酸被肿瘤细胞大量代谢利用,从而导致色氨酸的缺乏,会引发T细胞凋亡。IDO1抑制剂已被证明可以减轻TME中的免疫抑制,并在临床前模型中促进肿瘤特异性T细胞的活化。IDO1抑制剂联合免疫检查点抑制剂(ICIs)治疗黑色素瘤的疗效正在评估中。
脂肪酸
肿瘤细胞通常具有增加的从头脂肪酸合成速率,以将能量生产转移到合成代谢途径,从而产生质膜磷脂和信号分子。同时,脂肪酸合成为免疫细胞增殖提供了细胞膜和其他关键的脂质细胞结构,也是炎症巨噬细胞分化和功能所必需的。
此外,脂质代谢产物(如短链脂肪酸、长链脂肪酸、胆固醇等)在肿瘤浸润的髓系细胞(包括MDSCs、DCs和TAM)中的异常积聚,已被证明通过代谢重编程使这些免疫细胞向免疫抑制和抗炎表型倾斜。因此,许多学者认为脂肪酸对免疫细胞的调节机制不是改变细胞膜的组成或成为炎症介质,而是脂肪酸直接参与细胞内的信号传递。
胆固醇
胆固醇是细胞膜表面的重要组成部分。快速增殖的细胞需要更多的膜结构和更多的胆固醇合成。肿瘤细胞中胆固醇的高表达可以保护肿瘤细胞免受免疫监视并抵抗药物治疗。肿瘤细胞引起的高胆固醇可促进T细胞抑制性免疫检查点的表达,从而使其失去抗肿瘤作用。更重要的是,研究人员发现肿瘤细胞中胆固醇浓度远高于免疫细胞,免疫细胞中胆固醇浓度越高,PD-1、LAG-3、TIM-3等免疫检测点的表达越高,同样,免疫细胞也容易发生凋亡,细胞毒性和增殖能力越低。事实上,高胆固醇会破坏T细胞的脂质代谢网络,从而抑制免疫功能。
代谢酶对肿瘤免疫的影响
临床研究的结果显示,人类肿瘤中的有氧糖酵解活性与宿主抗肿瘤免疫反应和抗肿瘤免疫治疗的治疗结果呈负相关。例如,糖酵解途径中的三种限速酶,包括己糖激酶2(HK2)、磷酸果糖激酶1(PFK1)和丙酮酸激酶M2(PKM2),作为肝癌的标志,通过多种机制调节免疫逃逸,如AMPK、PI3K/Akt、HIF-1α、c-Myc和肝细胞癌中的非编码RNA。
除了糖酵解酶外,胆固醇代谢和转运酶对免疫细胞的功能、产生和活性也有重要影响。研究发现,T细胞代谢途径中的胆固醇酯酶ACAT1是一个很好的调节靶点。抑制ACAT1的活性可以大大提高CD8+T细胞的抗肿瘤功能。
此外,细胞外核苷酸酶CD39和CD73能显著上调肿瘤细胞外腺苷含量,导致免疫耐受,进而导致肿瘤生长失控。
代谢信号通路对肿瘤免疫的影响
mTOR信号通路
哺乳动物雷帕霉素靶蛋白(mTOR)是一种从酵母到哺乳动物高度保守的丝氨酸/苏氨酸蛋白激酶,在调节细胞生长和代谢中发挥重要作用。mTOR有两种不同的结构和功能:mTOR复合体1(mTORC1)和mTOR复合体2(mTORC2)。mTORC1可以促进蛋白质和核酸合成等合成代谢,抑制自噬等分解代谢,mTORC2可参与谷氨酰胺代谢,通过激活AGC激酶调节其细胞表面转运体来增加谷氨酰胺的摄取。

肿瘤细胞的mTOR信号通路通过影响肿瘤免疫促进肿瘤的发生和发展。例如,mTORC1能促进PD-L1的表达,抑制Treg细胞、NK细胞和T细胞的浸润,从而使肿瘤细胞逃避免疫细胞的杀伤。对黑色素瘤的研究发现,肿瘤细胞分泌抑制性细胞因子,减少T细胞向肿瘤微环境的浸润,使肿瘤细胞在mTORC2诱导的AKT活化后对免疫检查点抑制剂产生抵抗。
AMPK信号通路
AMPK是调节细胞能量稳态的关键分子,这种激酶的激活是对细胞内ATP消耗的应激反应,如低血糖、缺氧、缺血和热休克。AMPK负调控ATP消耗生物合成过程,包括糖异生、脂质和蛋白质合成。有趣的是,AMPK激活与免疫信号通路协同调节细胞免疫,并控制能量代谢,从而影响免疫细胞的激活。

有令人信服的证据表明,AMPK激活通过抑制促炎信号通路来阻止炎症反应。例如,在巨噬细胞中,AMPK的激活促进了M1促炎巨噬细胞向M2抗炎表型的极化。此外,AMPK激活调节巨噬细胞中抗炎细胞因子的信号传导,例如,增强IL-10诱导的对LPS刺激的细胞因子产生的抑制。
此外,AMPK的激活通过调节T淋巴细胞的能量代谢,在T淋巴细胞的分化和功能中起重要作用。这些结果清楚地表明AMPK信号在控制能量代谢和免疫反应之间的平衡。
腺苷信号通路
肿瘤微环境中积累的腺苷通过与细胞表面腺苷2A受体(A2AR)结合,抑制多种免疫细胞(包括细胞毒性T细胞和自然杀伤细胞)的抗肿瘤功能。外核苷酸酶CD39和CD73是细胞表面分子,分别通过将ATP分解为AMP和将AMP分解为腺苷来控制腺苷的产生。Treg细胞可表达CD39,并通过腺苷-A2AR信号轴参与TME的免疫抑制。靶向CD39和CD73以抑制腺苷的产生是增强抗肿瘤免疫的一个非常有吸引力的策略。
小结
显然,靶向肿瘤和/或免疫细胞的代谢重编程可与抗肿瘤免疫产生协同作用。了解和利用肿瘤细胞和免疫细胞中的代谢串扰,有可能提高免疫治疗通常获得的低应答率。尽管各种代谢药物和免疫疗法的联合应用已经在临床试验中得到应用,但要充分发挥联合疗法的治疗潜力,必须努力更好地了解肿瘤免疫逃避的代谢机制和免疫细胞的代谢需求。
值得注意的是,肿瘤细胞的代谢程序不仅影响免疫细胞的抗原提呈和识别,而且免疫细胞的代谢程序也会影响其功能,最终导致肿瘤免疫功能的改变。因此,代谢干预不仅可以改善免疫细胞对肿瘤的反应,而且可以增加肿瘤的免疫原性,从而扩大可以用免疫疗法有效治疗的癌症的范围。
参考文献:
1.The cancer metabolic reprogramming and immune response. Mol Cancer. 2021Feb 5;20(1):28.