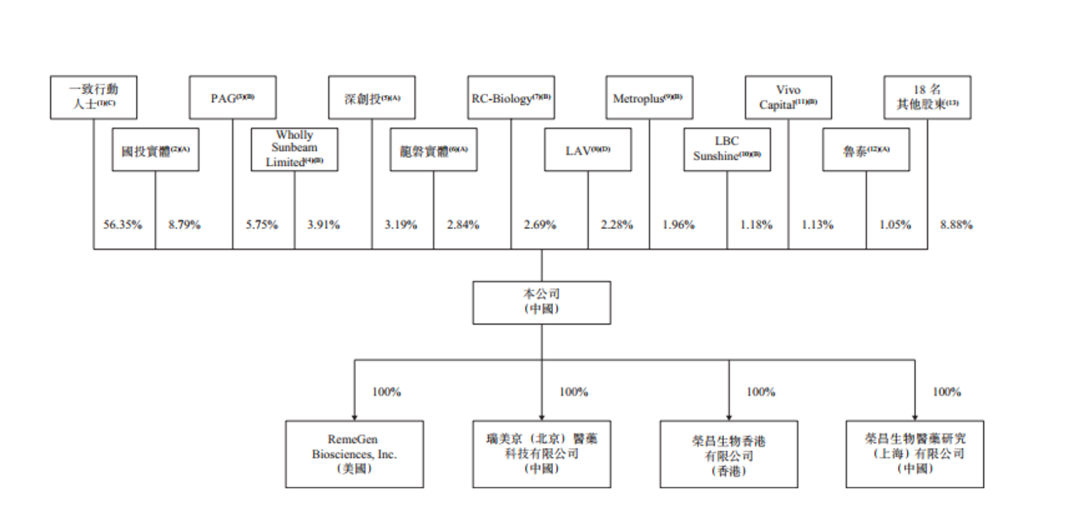
在今年3月份的Pre IPO轮融资中,荣昌生物估值13.72亿美元。
本文为IPO早知道原创作者|C叔
据IPO早知道消息,荣昌生物制药(烟台)股份有限公司已于本周一(10月20日)启动招股,预计募资规模约4亿美元。摩根士丹利、华泰国际以及摩根大通为本次发行上市的联席保荐人。
荣昌生物自2008年创立,就是一家致力于发现、开发和商业化同类首创(first-in-class)和同类最佳(best-in-class)新药的生物创新药公司,致力于攻克中国乃至全球多种医疗需求未被满足的自身免疫、肿瘤科和眼科疾病。
荣昌生物2019年12月重组完成后,不到半年已完成两轮融资。2019年12月,公司获太盟投资(PAG)投资9000万元,估值约54.47亿人民币。2020年3月,公司获礼来亚洲基金(LAV)、清池资本(LBC)等投资1.05亿美元,估值13.72亿美元。
与前一段时间上市的嘉和、云顶新耀引进管线的策略不同,荣昌生物产品管线都是来自于自主研发,技术含量大大超越前者,相信也将更吸引二级市场投资者关注。
耀眼的明星开发团队
公司创始人及高级管理人员在创新药物研发、临床开发及商业化方面拥有成功经验,并且具有国际化视野。
荣昌生物执行董事兼首席科学官,房健民博士,为现任同济大学教授、博导,同济大学苏州研究院院长。房教授多年从事生物药物、肿瘤生物学、免疫学等领域的研究,研究成果发表于多个国际顶尖杂志上,已经获得40多项发明专利。最令人熟知的是,他是我国第一个眼科一类生物新药“康柏西普(康弘药业)”的发明人和设计人。
荣昌生物首席医学官兼临床研究主管何如意博士,则拥有17年的美国FDA临床审批官的经验,在IND/DNA方面经验丰富。2018年10月起担任国投招商投资管理有限公司的医药健康首席科学家。自2016年7月至2018年10月,为NMPA药品审评中心的首席科学家。何博对于国内药审改革也做出了巨大贡献。
依托世界级生物药开发平台,打造高度特异性的候选药物
荣昌生物自2008年成立以来,先后投入20亿元用于研发和建设,搭建中华仓鼠卵巢细胞(CHO)和抗体-药物偶联(ADC)和双抗(Hi-Body)三大核心技术平台,已开发多项候选药物,包括5种针对17种适应症的临床开发阶段药物及5种以上为处于IND筹备阶段的候选药物,主要涉及到自身免疫疾病、癌症以及眼科类疾病。
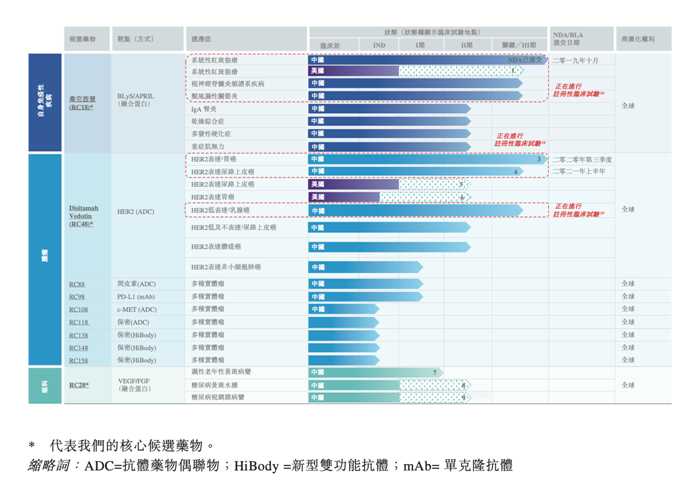
其中新型TACI-Fc融合蛋白泰它西普及新型抗HER2ADC药物DisitamabVedotin(RC48-ADC)现正通过共6项针对不同适应症的注册性临床试验进行评估,两种候选药物均展示出成为同类首创或同类最佳疗法的潜力。
公司目前已在烟台建设6个2000升的一次性生物反应器和全球顶级生产设施,并计划在2021年和2025年增加至36000升和80000升。目前的生产设施已通过欧盟的GMP审查,公司将会有充足产能满足很快到来的商业化生产要求。
泰它西普在中国用于系统性红斑狼疮 (SLE)的新药申请预计将于2020年第四季度获批
SLE 是一种慢性、多系统及无法治愈的自身免疫性疾病,美国著名歌星Lady Gaga就曾透露自己深受红斑狼疮的困扰。
SLE可能导致严重的器官损伤、全身并发症甚至死亡,常见症状包括关节疼痛及肿胀、不明原因的发热、 胸痛、脱发、口腔溃疡、淋巴结肿大、极度疲倦及最常见于面部的红疹。疾病晚期,患者可能会出现肾脏损伤及肾功能衰竭。
SLE的新药研发异常艰难,近年国际上多个项目以失败告终。自1955年的羟氯喹以来,美国FDA在过去的60多年只批准过一个治疗SLE新药上市。目前用于治疗SLE的药物可能存在重大风险及不良反应。贝利木单抗是目前全球唯一上市用于SLE治疗的单抗药物。然而,贝利木单抗亦存在疗效有限、起效慢、标识受限、价格高昂等局限性。
从荣昌此前公布的临床数据显示,泰它西普展现出了比贝利木单抗更优的疗效潜力,未来有望成为SLE领域最佳的生物制剂。泰它西普高剂量组的有效率高达79.2%,并且具有新结构、新机理、新靶点的特征,已于近日向国家药品监督管理局申报新药上市,有希望成为中国生物创新药物的“First-in-class”。
泰它西普如果获批,将是一个里程碑式的事件。同时,其在视神经脊髓炎频谱系疾病(NMOSD) 及类风湿性关节炎 (RA) 的适应症上也展现出了不俗的潜力,管线的价值毋庸置疑。
国内商业化最快的HER2-ADC,也是在中国进入临床首个自主开发的ADC
ADC药物也是这两年市场最热的新药种类之一,ADC药物的作用机制是在一个单克隆抗体分子上,连接多个小分子化疗药物,形成被称为“生物导弹”的ADC药物。ADC药物的抗体部分如同精确制导的微形火箭,可以精准地瞄准肿瘤细胞,并进入癌细胞内部,ADC药物所携带的化疗药物就象是火箭上的炸药,能高效杀死肿瘤细胞。
全球第一个ADC药物在2000年获批,目前为止已有9个ADC药物获批,其中 Kadcyla(曲妥珠单抗及emtansine的ADC药物)是一线治疗中接受曲妥珠单抗、帕妥珠单抗及紫杉醇治疗的HER2高表达转移性乳腺癌患者的标准二线疗法。国内目前只有两种ADC药物,即Kadcyla及Adcetris,于2020年获得NMPA批准上市,中国进展最快的本土企业为荣昌生物的RC48-ADC和百奥泰的BAT-8001。
在当前获批的ADC药物中,主要适应症以实体瘤和乳腺癌为主,展现出相当不错的疗效,荣昌的RC48-ADC适应症差异化设计,一定程度上避开了与国外竞品的适应症竞争,荣昌的RC48-ADC在胃癌注册性临床研究及尿路上皮癌 II期临床研究中已表现出优异的抗肿瘤活性和良好耐受性。
尤其是在接受RC48-ADC治疗的43例二线及多线尿路上皮癌受试者中,客观缓解率(cORR)高达51.2%,疾病控制率(DCR)高达90.7%。欧美国家先后批准了几个抗PD-1/PD-L1抗体药物,用于尿路上皮癌的二线治疗,但整体缓解率仅20%左右。这意味着荣昌生物的RC48-ADC获批,将成为尿路上皮癌中的二线首选药物。
房健民博士领衔的升级版康柏西普(RC28),眼科又一重磅炸弹
RC28是一种重组双诱饵受体IgG1 Fc融合蛋白,同时针对VEGF和FGF家族。VEGF和FGF这两种生长因子是血管生成的关键途径调节因子,在糖尿病患者中水平较高。某些眼科疾病,如湿性AMD、DME和DR,在血管长入黄斑时发生,导致液体从血管漏入眼睛。这些渗漏的血液或液体可能导致进行性视力丧失和失明。
通过与VEGF和FGF结合,RC28可以阻断VEGF和FGF家族中的血管生成因子,从而有效减缓新生血管的生长,最终减缓疾病进展。
针对这类疾病,康弘药业的康柏西普效果明显,而康柏西普也是房健民博士研发,此次的升级版本更大概率将拥有超群的效果,极有可能带给投资者们更大的信心。
除了这三款进展靠前的重磅药物之外,荣昌还有一种新型间皮素靶向ADC(RC88),用于治疗实体瘤,RC98一种新型PD-L1单克隆抗体。此外,还有2款ADC和基于自主Hi-Body双抗平台的多款双抗药物。
拥有优异的自主研发管线和经过市场验证的卓越管理者及研发团队,荣昌生物料将成为近期港股创新药领域一颗最耀眼的明星。







