CRISPR-Cas技术是目前最为简洁高效的基因编辑系统,作为一项重大的科学发现,自2013年哈佛大学医学院、博德研究所和加州大学旧金山分校等将该系统应用到哺乳动物细胞中实现对复杂基因组的特异性编辑后,CRISPR技术快速发展并已经得到广泛应用,并迅速进入人类疾病治疗领域,其代表性公司包括Editas Medicine、CRISPR Therapeutics和Intellia Therapeutics等。
由于基因编辑技术的应用边界不断拓宽和其衍生技术的发展,该类技术已经从最初遗传学疾病领域进入到心血管和神经系统等复杂疾病以及癌症领域等。地中海贫血的CRISPR基因编辑疗法目前进展较快,有望成为全球基因编辑临床转化领域的标杆性治疗产品。
早在2015年,由中国科学家黄军就领衔的科研团队就开始探索该技术在β-地中海贫血的临床治疗可行性,其研究成果也被《Nature》杂志评选为当年的全球十大科技人物(1),为利用新型基因编辑技术治疗遗传性疾病打开了无限想象空间。
递送系统是影响基因疗法有效性和安全性的重要因素。特别是对于体内(in vivo)基因编辑疗法,需要把单碱基编辑系统递送至体内并确保其高效性。腺相关病毒(AAV)是主流的递送手段。然而AAV包装基因药物的大小必须<4.8kb,而5.4kb的单碱基编辑体系ABE无法通过一个AAV递送到体内。
立足于基因疗法中递送系统这一关键问题的创新和探索,中山大学黄军就研究团队近日在《Small Methods》杂志(IF:12)上发表了题为“Development of Highly Efficient Dual-AAV Split Adenosine Base Editor for In Vivo Gene Therapy”的研究报道(2,3)。
该研究获得了比以往更加高效的双AAV递送效率,并在动物模型上进行了肝脏和眼科疾病相关基因靶标的有效验证,为碱基编辑疗法建立了一套具有国际领先水平的AAV组合策略,为精准基因治疗提供新的方法。这也是该研究团队在基因编辑领域相关课题持续投入的又一个潜在临床转化价值的技术成果。
目前有两种策略可能解决单碱基编辑体系递送的问题。一种是利用RNA反式剪切体系,但剪切体系效率很低,仅有1%。另一种策略通过内含肽(intein)介导的蛋白剪切体系,相比RNA剪切体系,蛋白剪切体系更加有效。
通过筛选不同种属来源的inteins,匹配不同的ABE拆分方法,研究人员最终筛选出编辑效率最高的两种组合方案,ABE-Rma573和ABE-Rma674(图1)。研究人员分别在小鼠肝脏和眼睛中证实了利用双AAV递送该编辑体系可以在 in vivo水平实现高效的单碱基编辑(图2)。
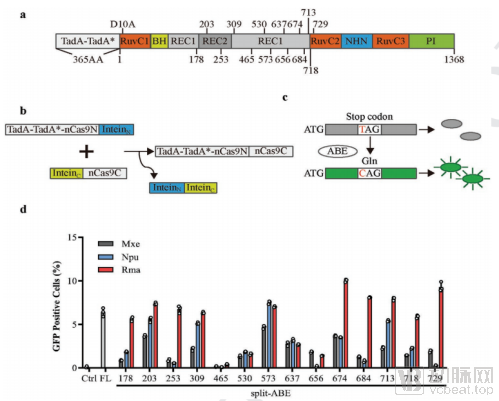
图1. ABE双AAV载体构建的筛选体系

图2. 通过双AAV介导Split-ABE递送到小鼠体内实现肝脏和视网膜中靶细胞的高效单碱基编辑
在确定高效递送策略后,研究人员随后基于该系统先在小鼠肝脏上进行了效果验证。通过双AAV递送单碱基编辑系统,研究人员成功诱导小鼠肝脏中PCSK9基因的A-G的单碱基编辑,效率高达6%。在split-ABE-Rma573处理后6周,关键指标血清PCSK9蛋白下降近50%,血清极低密度脂蛋白和低密度脂蛋白 (VLDL/LDL)下降近25%,且未见肝脏损伤。PCSK9是心血管疾病药物开发领域最广发的的治疗靶点,具有巨大的临床应用价值,这一类新药开发有望惠及全球数亿人群。
2019年底诺华斥资近100亿美元收购了The Medicines Company(4),该公司一直在研发一款针对PCSK9的小RNA核酸药物。该药物的成功将有望首次实现为疾病人群提供长效核酸类药物的愿景。
另一方面,基于基因单碱基编辑技术的PCSK9药物似乎更能体现一次给药终身治愈的效果,今年7月,Verve Therapeutics公司在国际干细胞研究学会会议公布了其在非人灵长类动物的研发数据,利用碱基编辑技术成功关闭了食蟹猴肝脏PSCK9的表达,显著降低了血液中的LDL胆固醇和甘油三酯水平,且未发现脱靶效应。这也是基因降脂药开发的一个令人惊喜的里程碑(5)。
基因编辑疗法的另一大适应症是眼科疾病,如遗传性致盲视网膜疾病、慢性退行性病变等,其中,Spark Therapeutics研发的基因药物Luxturna是FDA批准的首款眼科基因治疗药物(6)。由先驱基因编辑华人科学家张峰参与创办的Editas Medicine的先天性黑蒙症基因编辑疗法也已经进入早期临床试验阶段。黄军就研究团队同样也在眼科进行了验证,利用该系统成功实施与Goldmann-Favre综合征相关的视杆细胞特性基因NR2E3和与老年黄斑变性相关的血管生长因子VEGFA的A-G单碱基编辑,在小鼠视网膜中编辑效率高达25%。
黄军就研究团队长期以来一直专注于基因编辑和干细胞领域的学术创新及其临床转化工作,自2015年在全球范围内率先实现针对全球受累人群最广泛的遗传病地中海贫血成功实现基因编辑和单碱基修复以来,该团队也在肝脏和眼科领域开展了基因编辑技术应用的科学探索。递送和编辑效率是基因编辑疗法的核心部分,该研究成果表明,这种高效双AAV单碱基编辑递送系统以及其在动物模型的概念验证为人类遗传和非遗传性疾病的精准基因治疗提供更有优势的治疗选项。
国内从事基因编辑疗法开发的代表性公司
>>>>
1 瑞风生物 Reforgene
瑞风生物是一家处于临床前阶段、致力于开发具有治愈性价值的基因药物的高科技企业。研发团队来自美国MD安德森癌症中心、纽约大学和中山大学等知名研究机构。瑞风从掌握生命活动本质的底层代码出发,以人才和技术为驱动力,结合基因编辑和基因组学等领先手段,聚焦于新一代核酸层面高度可编程药物的创新。瑞风生物的创始团队来自产业和学术界,包括梁峻彬博士和中山大学黄军就教授,获得联想之星和联想控股集团共同投资。
>>>>
2 博雅辑因 Edigene
博雅辑因成立于2015年,致力于将前沿的基因组编辑技术转化为治疗遗传病和癌症的创新疗法,以及药物研发的创造性解决方案。博雅辑因的投资机构包括IDG、礼来亚洲和华盖资本等,由北京大学魏文胜教授创建,聚集了一支具备完整药物开发及临床实验经验的专业管理团队。
>>>>
3 邦耀生物 Bioray Lab
上海邦耀生物科技有限公司成立于2013年,是一家以基因编辑技术引领创新,开发突破性疗法,造福全人类为使命的高新技术企业,由华东师范大学刘明耀教授团队等多名学者创办,成员包括国家特聘教授、长江学者等。邦耀已获得了东方富海领投的天使轮融资以及华润领投的Pre-A轮近亿元融资,用于开发治疗B细胞恶性血液病的异体细胞疗法UCART的国内外新药申报及注册临床推进,助力公司在CART领域的早日实现新突破,目前已申请专利40余项。
>>>>
4 辉大生物 Huigene
辉大(上海)生物科技有限公司于2018年10月,由中科院神经科学研究所杨辉研究员和姚璇博士创立。是一家专注于基因治疗药物研发和转化的高新生物科技公司。2018年11月获得数千万元天使轮投资,2019年11月完成逾亿元A轮融资。公司拥有500㎡基因治疗研发实验室(BSL-2), 500㎡ SPF级实验动物房以及4000㎡基因治疗生产车间(建设中),涵盖基因编辑技术平台、AAV技术平台、疾病模型动物平台和工艺转化及生产平台,致力于成为国内最好、世界领先的基因治疗平台。

作者:动脉网









