蛋壳研究院发布的《医疗器械研发外包服务行业创新报告》显示,器械CRO/CDMO行业经过前期发展,已经成为医疗器械研发主体降低前期投入、加快注册申报进程、减少产品上市风险的重要战略选择。2019年,全国器械CRO/CDMO行业市场规模达100亿元,未来年均复合增速将超过20%。
医疗器械从研发到上市困难重重,器械CRO/CDMO服务可辅助医疗器械研发商降低投入成本,加速产品上市效率。目前,医疗器械注册人制度多地试点,政府鼓励医疗器械创新,器械CRO/CDMO行业迎来发展机遇。
正是在国家推行医疗器械注册人制度及湖南省鼓励医疗器械产业创新发展的大背景下,迅佳科技由一批医疗行业资深人士发起成立。其在湖南湘潭打造的CDMO一体化平台(CDO+CRO+CMO+CSO)是湖南省食品药品监督管理局指导下的湖南首家医疗器械注册人制度CDMO一体化平台,是湘潭湖南省医疗器械产业园独家的CDMO一体化平台。
据迅佳科技联合创始人胡红平介绍:“以湖南省医疗器械创新及注册人制度试点政策为依托,迅佳科技打造了医疗器械CDMO一体化平台,链接政、产、学、研、医、金等医疗器械全产业要素,提供从专利孵化、设计研发、检验及注册到委托生产、渠道销售的医疗器械全流程服务模式。”
由于经济发达地区医疗产业繁荣,医疗资源相对集中,有更多前沿的市场信息及客户资源。因此,迅佳科技目前主要在长三角、湖南省及华中地区、珠三角、京津冀等地区开展业务。
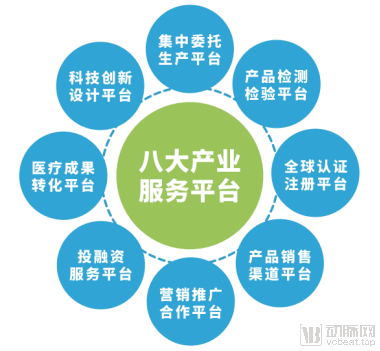
八大产业服务平台,解决医疗器械行业的“六难三高”难题
医疗器械从研发到上市需要经过概念验证、产品研发、动物实验、筹建产线、建立体系、筛选原材料、工艺验证、供应链管理、生产样品、注册检验、临床评价、注册证申办等多个环节。
这其中每个环节都具有一定的不确定性和风险,如厂房的规范性、原材料的稳定性、样品能否通过注册检验、产品临床试验效果能否达到预期设计等。医疗器械企业的每一款新产品,从研发到生产、销售,每一步都如履薄冰。
中小型医疗行业通常面临“六大难题”——融资难、研发难、转化难、生产难、销售难、监管难;医疗企业存在 “三高门槛”——研发门槛高、市场准入门槛高、产品销售渠道门槛高的问题。为此,迅佳科技打造CDMO一体化平台,链接政、产、学、研、医、用、金、介、贸、媒等医疗全产业要素,为医疗行业及企业突破“六难三高”难题,提供新方法及新路径。
迅佳科技CDMO一体化平台

企业供图
通过医疗成果转化平台、科技创新设计平台、集中委托生产平台、产品检测检验平台、全球认证注册平台、产品销售渠道平台、营销推广合作平台、投融资服务平台,迅佳科技链接国际及国内外的知名医疗行业专家、科研机构、高校、协会、企业、资本,解决医疗器械企业的科研转化、研发、生产、注册认证、销售渠道及融资等难题。
迅佳科技八大产业服务平台
企业供图
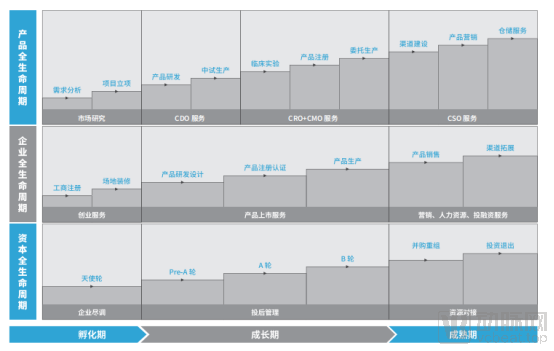
迅佳科技提供全生命周期服务,其中,迅佳科技从产品、企业、资本三方面着手。产品全生命周期,迅佳科技通过CDMO一体化平台,辅助企业合法合规低成本快速获证,尽早取得经济效益。同时,迅佳科技希望帮助医疗器械企业降低产品研发难度及生产成本,减少前期投入。
企业全生命周期,迅佳科技拥有专业的医疗行业管理团队,提供财务、人才、地方政策等服务支持。产品获证生产后,通过搭建的销售联盟,快速占领市场,形成效益。同时,迅佳科技希望帮助创新企业获得融资,尽快成长。
资本全生命周期,迅佳科技通过专业的投资管理团队,为投资机构匹配合适的项目。此外,迅佳科技还可帮助被投企业尽早获得医疗器械注册证,确保项目的投资回报率,助力资本顺利退出。
迅佳科技全生命周期服务
企业供图
四大优势打造核心竞争力,助力医疗器械注册人制度发展
据胡红平介绍,截至2020年6月30日,已有数十家医疗器械企业入驻CDMO一体化平台,预计今年获得各类注册证200张。能够有此成果,离不开迅佳科技CDMO平台的独特性。
硬件优势:迅佳科技打造的CDMO一体化平台包含医疗众创空间及满足医疗器械注册人制度要求的集中委托生产平台。众创空间规划有公共活动区、展示区、健身房、路演大厅、企业独立办公区等,可协助企业进行工商注册、财务、人才、政策等多方面专业服务。集中委托生产平台一期总面积9500平方米,已打造满足医疗器械注册人制度要求的无菌生产平台、非无菌生产平台、IVD产品生产平以及公共实验室、公共冷库、公共危化物仓库、灭菌中心等,实现共享生产。企业入驻平台后,可快速获得注册证,快速进行体系考核获取生产许可证,从而使得产品快速推向市场。
服务优势:迅佳科技提供专利孵化、设计研发、医工转化、检测检验、注册认证、委托生产、产品销售、渠道开发、投融资、产业政策制定及咨询等一站式服务,且合作模式灵活,如客户可选择CRO或CRO+CMO或CDO+CRO+CMO。针对不同客户群,迅佳科技提供定制化服务。对于需要集中生产的省外快速转移企业,迅佳科技提供委托生产及注册申报服务;对于有新产品需要注册的生产企业,迅佳科技提供检验检测、临床试验、注册申报、委托生产等服务;对于科研机构、创新企业、渠道商转型企业,迅佳科技提供产品研等全流程服务。
迅佳科技合作模式

企业供图
团队优势:截止目前,迅佳科技已招收50多位专业化医疗相关人才。其中,研发型人才15名,法规型人才12名,复合型人才10名。其中,核心管理团队成员的从业经验都超过20年,在医疗器械领域积累了丰富的资源及管理经营。核心创始人团队在医疗器械的医工转化及生产、医疗渠道销售、医疗产业投资等医疗全领域经验,特别是迅佳科技董事长杜晓东,是湖南医疗器械创新政策落地的推动者;核心管理团队在医疗法规及注册、医疗器械的软硬件研发、产品工业设计、生产及供应链管理等方面,都具有丰富的经验,能为平台企业提供全方位的服务,能助力企业突破“三高门槛”。同时,公司也建立了完备的人才培养体系及梯队建设,并配合以相应的激励计划,确保留住人才。
政策支持:国家药品监督管理局在2019年8月1日发布《国家药监局关于扩大医疗器械注册人制度试点工作的通知》,鼓励湖南等21个省(自治区或直辖市)开展医疗器械注册人制度试点。2019年10月10日,湖南省药品监督管理局发布《湖南省医疗器械注册人制度试点工作实施方案》。湖南试点方案指出,采取委托生产方式的湖南省医疗器械注册人,产品可委托湘潭市湖南医疗器械产业园区及省内其他有条件的医疗器械生产企业生产。湖南省企业可受托生产其他20个试点省(市)注册人的医疗器械。
总结来看,湖南省实施医疗器械注册人制度的亮点在于:外省市已取得的二类医疗器械注册证实行优先审批;拓展了注册检验途径,允许第三方检测;鼓励创新、减时限、减环节、简资料、优化临床评价。
胡红平表示:“湘潭湖南医疗器械产业园区中,迅佳科技是独家的CDMO平台。”凭借湖南省医疗器械创新的发展政策、湘潭湖南省医疗器械产业园交通便捷的地理位置、聚集的医疗产业优质资源等优势,迅佳科技可帮助已有二类医疗器械注册证的企业快速拿证;帮助需要注册医疗器械的企业缩短拿证周期;帮助需要批量生产医疗器械的企业生产产品,大幅减少企业投资成本,合法合规的加速医疗器械产品上市,使企业快速取得经济效益。
最后,胡红平告诉动脉网:“迅佳科技的愿景是聚集国际及国内外医疗产业优质资源,合作共建专业化科技创新平台,赋能医疗科技创新,构建价值延伸的生态链,驱动医疗器械产业创新发展。公司全体成员将为实现愿景而努力奋斗。”
作者:张靖



